
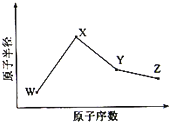
 ,Cl元素的最高价氧化物的水化物是高氯酸,其化学式为HClO4;
,Cl元素的最高价氧化物的水化物是高氯酸,其化学式为HClO4;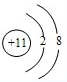 ;
; ;HClO4;
;HClO4;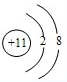 ;
;

科目:高中化学 来源: 题型:
| A、全部 | B、②③④⑤ |
| C、只有②③④ | D、只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol Al与足量盐酸反应转移电子数为1.5NA |
| B、标准状况下,11.2 L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为16NA |
| D、46 g NO2和N2O4的混合物含有的分子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂 |
| B、近年来禽流感病毒H7N9时有病例报告,卫生部门强调要尽量避免接触活禽,个人也应加强消毒预防,其中消毒剂可以选用含氯消毒剂、酒精、双氧水等适宜的物质 |
| C、食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
| D、碘的升华、溴水中萃取溴、石油的分馏均是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
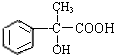 的分子式
的分子式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
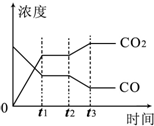 对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
对于反应CO(g)+H2O(g)?H2(g)+CO2(g)| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
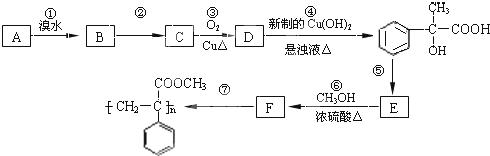
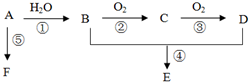 已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com