
科目:高中化学 来源: 题型:
| 编 号 | A | B | C | D |
| X的化学式 | Na | Na2O | Na2O2 | NaOH |
| 加入X的质量(g) | 2.3 | 6.4 | 7.8 | 16.0 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(Na2CO3) |
| n(NaHCO3) |
| A、a=1则c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、a=2则c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、a为任意值时,则c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、a=0则c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、给试管内的液体加热,可使试管口对准自己,不能使试管口对准别人 |
| B、用KMnO4制取O2时,先检验装置的气密性,然后再加药品 |
| C、把NaOH固体直接放在天平的左盘上称量 |
| D、稀释浓H2SO4时,可向盛浓H2SO4的量筒中小心加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入水时,平衡逆向移动 |
| B、加入少量NaOH固体,平衡正向移动 |
| C、加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 |
| D、加入少量CH3COONa固体,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
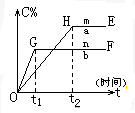 对于反应xA(g)+yB(g)?pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
对于反应xA(g)+yB(g)?pC(g)+qD(g)压强与温度对C的质量分数的影响如图:查看答案和解析>>
科目:高中化学 来源: 题型:
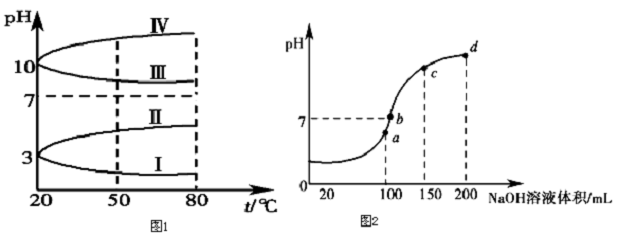
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com