
【题目】对于反应A2(g)+3B2(g)![]() 2AB3(g)来说,下列反应速率中表示该反应进行得最快的是( )
2AB3(g)来说,下列反应速率中表示该反应进行得最快的是( )
A.v(AB3)=12mol·L-1·min-1B.v(B2)=2.7mol·L-1·min-1
C.v(A2)=0.25mol·L-1·s-1D.v(A2)=6mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物。下列说法正确的是( )
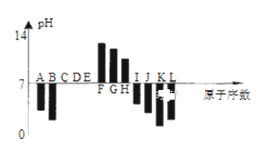
A.元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大
B.根据图形分析可知,K、L两种元素最高价氧化物对应的水化物的酸性,前者较强
C.晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同
D.元素K、H、G分别形成的简单离子的半径逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为![]() 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:
![]()
下列说法正确的是![]()
窗口编号 | 温度 | 起始物质的量 | 平衡物质的量 | |
|
|
| ||
1 | 380 |
|
|
|
2 | 380 |
| ||
3 | 230 |
|
|
|
A.该反应的正反应为放热反应
B.达到平衡时,容器1中的![]() 体积分数比容器2中的小
体积分数比容器2中的小
C.容器1中反应达到平衡所需的时间比容器3中的长
D.若起始时向容器Ⅲ中充入![]()
![]()
![]() 、
、![]()
![]()
![]() 和
和![]()
![]() ,则反应向逆反应方向进行
,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个固定容积均为1L密闭容器中以不同的氢碳比![]() 充入
充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]() 的平衡转化率
的平衡转化率![]() 与温度的关系如图所示.下列说法正确的是
与温度的关系如图所示.下列说法正确的是![]()
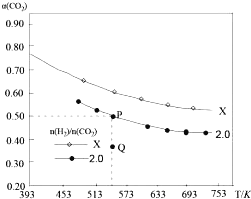
A.该反应在高温下自发进行
B.X的氢碳比![]() ,且Q点在氢碳比为
,且Q点在氢碳比为![]() 时
时![]()
C.若起始时,![]() 、
、![]() 浓度分别为
浓度分别为![]() 和
和![]() ,则可得到P点,对应温度的平衡常数的值为512
,则可得到P点,对应温度的平衡常数的值为512
D.向处于P点状态的容器中,按2:4:1:4的比例再充入![]() 、
、![]() 、
、![]() 、
、![]() ,再次平衡后
,再次平衡后![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20g烧碱配制成500mL溶液。
(1)所得溶液的物质的量浓度为多少?(写出计算过程,下同)
(2)从中取出lmL,将其用水稀释到l00mL,所得溶液中溶质的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn+2OH--2e-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com