
【题目】山豆根查尔酮具有清热解毒的作用。下列说法错误的是( )

A.它的化学式为C30H34O4。
B.分子中所有的C原子可能共面。
C.1mol山豆根查尔酮最多消耗NaOH、H2的物质的量分别为3mol、11mol。
D.可以用浓溴水检验山豆根查尔酮的存在。
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】NM3是处于临床试验阶段的小分子抗癌药物,分子结构如图。下列说法正确的是
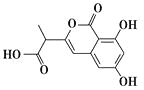
A.该有机物的分子式为C12H12O6
B.1 mol该有机物最多可以和3 mol NaOH反应
C.该有机物容易发生加成、取代、消去等反应
D.该有机物分子中只含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种制备氢氧化亚铁的方法,且能保存相对较长时间,根据装置图请回答下列问题:

(1)本实验中为制得氢氧化亚铁如何保证无氧条件_____。
(2)在将硫酸亚铁压入制得氢氧化亚铁的操作之前必须要进行的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料合成中间体,其合成路线如图:
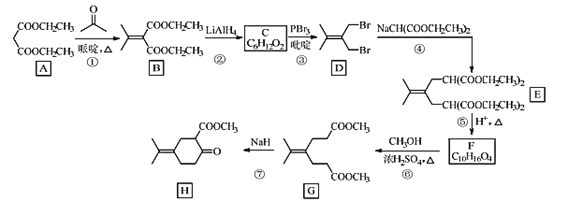
回答下列问题:
(1)A的化学名称是___。
(2)A到B的反应方程式是___。
(3)C的结构简式是___。
(4)④的反应类型是___。
(5)H中的含氧官能团的名称是___。
(6)X是F的同分异构体,X所含官能团的种类和数量与F完全相同,其核磁共振氢谱为三组峰,峰面积比为6:1:1。写出两种符合上述条件的X的结构简式___。
(7)设计由苯甲醇和 制备
制备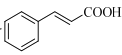 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)反应开始到10s,用Z表示的反应速率___________________
(2)反应开始到10s时,Y的转化率为__________________
(3)反应的化学方程式为:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol,②2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ/mol,③2CO(g)=2C(s)+O2(g)△H=+220.8kJ/mol,④2C(s)+2O2(g)=2CO2(g)△H=﹣787kJ/mol,回答下列问题:
(1)上述反应中属于放热反应的是_____(填写序号)。
(2)H2的燃烧热为_____。
(3)燃烧10g H2生成液态水,放出的热量为______。
(4)H2O(g)=H2O(l)△H=________。
(5)C(s)的燃烧热的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3A(g)+B(g)![]() 2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.9 mol·L-1·min-1B.v(B)=0.2mol·L-1·min-1
C.v(C)=0.5mol·L-1·min-1D.v(D)=1.0mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[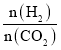 ]的变化如图所示:
]的变化如图所示:
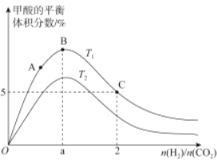
①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com