
【题目】常温下,下列无色溶液中一定能大量共存的离子组是
A. K+、Cu2+、NO3-、SO42- B. K+、H+、Fe2+、NO3-
C. NH4+、K+、OH-、SO42- D. Na+、NH4+、Cl-、NO3-
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 装置 |
装置一 |
装置二 |
装置三 |
装置四 |
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极 流向d极 |
由此可判断这四种金属活动性顺序是( )
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔是七个基本物理量之一
B. 1molH2SO4中含有阿伏伽德罗常数个氢原子
C. 1个氧气分子的质量约为32/NA g
D. 硫酸根离子的摩尔质量是96 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,把一个盛有一定量甲烷和氯气的密闭容器放在光亮的地方,两种气体发生反应,下列叙述不正确的是
A. 容器内原子总数不变 B. 容器内分子总数不变
C. 容器内压强不变 D. 容器内壁出现油状液滴,且气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I: CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
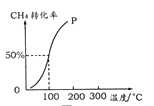
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c ( H2 )减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡c ( H2 )/ c (CH3OH )减小 E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程
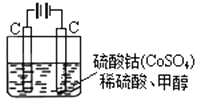
①写出阳极电极反应式 。
②请写出除去甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙与盐酸反应:CO32-+H+=H2O+CO2
B.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
C.硝酸与氢氧化钡反应:OH-+H+=H2O
D.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素[CO(NH2)2·H2O2]是一种白色粉末,溶于水形成的溶液呈弱酸性。过氧化尿素不稳定,在痕量重金属离子等活性催化剂的存在下迅速分解。工业生产过氧化尿素的原理和流程如下。
原理:CO(NH2)2+H2O2 ![]() CO(NH2)2·H2O2
CO(NH2)2·H2O2
流程:
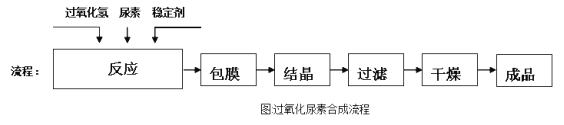
回答下列问题:
(l)已知过氧化尿素[CO(NH2)2·H2O2]中的CO(NH2)2与H2O2以氢键连接,其中碳元素的化合价是___________。(填序号)
A. +2价 B. -l价 C. 0价 D. +4价
(2)过氧化尿素鉴定反应:在重铬酸钾酸性溶液中加入乙醚和少许过氧化尿素,振荡。上层乙醚呈蓝色,这是由于在酸性溶液中过氧化尿素中的过氧化氢与重铬酸钾反应生成较稳定的蓝色过氧化铬(CrO5)。写出H2O2与重铬酸钾反应的离子方程式__________。
(3)经过上述化学工艺后的产品是粗产品。已知30℃时尿素的溶解度远大于过氧化尿素的溶解度,则提纯粗产品的操作顺序是___________ (填序号)。
①冷却至30℃结晶 ②过滤 ③蒸发浓缩 ④溶解 ⑤洗涤
(4)在实验室中采用上述原理制取过氧化尿素,搅拌器的材质一般用玻璃而非铁质,原因是___。
(5)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________。
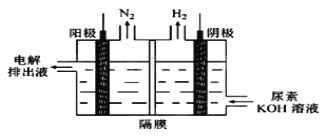
(6)Ⅰ.为测定产品中H2O2的含量,常用KMnO4溶液滴定H2O2,高锰酸钾标准溶液通常放置时间较长,因此在滴定H2O2前,常用现配的草酸钠溶液先标定出KMnO4标准溶液的浓度。
Ⅱ.称取过氧化尿素样品4.000g ,溶解在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1.00mL 6mo1/L的硫酸,用标定过的0.2000mol/L的高锰酸钾标准溶液滴定至滴入最后一滴时溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4标准溶液10.00mL,(KMnO4与尿素不反应)。
①H2O2的质量分数是_______ (精确至0.1%)。
②若装草酸钠溶液的滴定管水洗后未润洗,最终H2O2的质量分数______ (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是:
A.钠在空气燃烧时先熔化,再燃烧,最后所得的产物是Na2O2
B.铝因在空气中形成了一薄层致密的氧化膜,保护内层金属,故铝不需特殊保护
C.铝制品在生活中非常普通,是因为铝非常不活泼
D.铁因在潮湿的空气中形成的氧化物疏松,不能保护内层金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性问题,我国已经开始实施“智力工程”,最经济可行的措施是
A. 食盐加碘(盐) B. 面包加碘(盐)
C. 大量食用海带 D. 注射含碘药剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com