
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 装置 |
装置一 |
装置二 |
装置三 |
装置四 |
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极 流向d极 |
由此可判断这四种金属活动性顺序是( )
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c
科目:高中化学 来源: 题型:
【题目】【2015新课标1】[化学——选修5:有机化学基础]
A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:
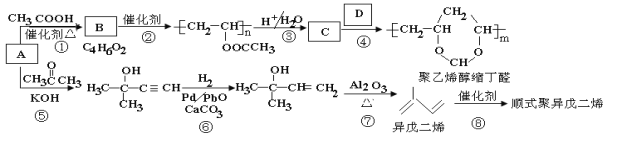
回答下列问题:
(1)A的名称是 ,B含有的官能团是 。
(2)①的反应类型是 ,⑦的反应类型是 。
(3)C和D的结构简式分别为 、 。
(4)异戊二烯分子中最多有 个原子共平面,顺式聚异戊二烯的结构简式为 。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体 (填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是
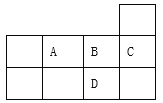
A. 原子半径大小为:B>A>C
B. 核电荷数:D > C>B >A
C. A与D形成的化合物均是离子键
D. 生成的氢化物的稳定性为: D >A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③12 C和14 C
④CH3CH2CH2CH2CH3和(CH3)2CHCH2CH3 ⑤癸烷和十六烷 ⑥CH3(CH2)5CH3和CH3CH2CH(CH3)C2H5
⑦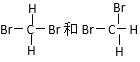
A、互为同位素的是_________;B、互为同分异构体的是________;
C、互为同素异形体的是________;D、同一种物质的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是
A.SiO2和干冰的熔化 B.氧化钠和钠的熔化
C.晶体硅和晶体硫的熔化 D.碘和干冰的气化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关卤素及其化合物的制备和性质探究实验,请同学们参与他们的实验并回答下列问题。
【实验一】氯气的制备与性质
(1)用下图所示的实验装置来制备纯净、干燥的氯气,并完成它与金属铁的反应。每个虚线框表示一个单元装置,其中有错误的是_____(填字母序号)。
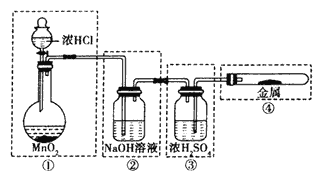
A.只有②和④ B.只有② C.只有①和③ D.②③④
【实验二】卤素化合物的性质实验探究
已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在100℃左右时升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,如:12FeCl2+3O2![]() 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2![]() 2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。
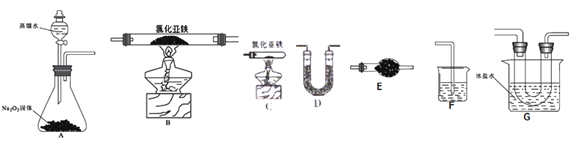
(2)实验装置的合理连接顺序为:A→____________→F。
(3)A装置中反应的化学方程式为________________。
(4)当加热装置中充分反应后,余下的固体是_________;本套实验装置的主要缺点是_____________。
(5)利用反应生成的FeCl3设计实验证明Fe(OH)3是弱碱,实验方案为____________。
【实验三】卤素化合物反应实验条件控制探究
(6)在不同实验条件下KClO3可将KI氧化为I2或KIO3。该小组设计了一系列实验来研究反应条件对反应物的影响,其中某一实验的数据记录如下(实验控制在室温下进行):
试管标号 | 1 | 2 | 3 | 4 |
0.20mol·L-1KI溶液/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol/L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①该组实验的目的是________________________。
②设计1号试管实验的作用是_______________________。
③若2号试管实验现象为“反应后溶液呈黄色”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 ![]() (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.![]() (NH3) = 0.010 mol/(L·s)
(NH3) = 0.010 mol/(L·s)
B.![]() (O2) = 0.0010 mol/(L·s)
(O2) = 0.0010 mol/(L·s)
C.![]() (NO) = 0.0010 mol/(L·s)
(NO) = 0.0010 mol/(L·s)
D.![]() (H2O) = 0.045 mol/(L·s)
(H2O) = 0.045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为____________________。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为_______________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于_________________。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为___________,中心原子杂化类型为_________。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为_______ (填序号)。
(6)Cl2和水能发生反应,生成物中有一种为三原子分子,写出该化合物的电子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列无色溶液中一定能大量共存的离子组是
A. K+、Cu2+、NO3-、SO42- B. K+、H+、Fe2+、NO3-
C. NH4+、K+、OH-、SO42- D. Na+、NH4+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com