
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
【答案】 250ml容量瓶 ![]()
![]()
![]() pH约为6时,Fe3+和cr3+已沉淀完全,而Ni2+还未开始沉淀 C
pH约为6时,Fe3+和cr3+已沉淀完全,而Ni2+还未开始沉淀 C ![]() A D 加入稀硝酸至溶液显弱酸性
A D 加入稀硝酸至溶液显弱酸性
【解析】(1)实验需要配制3.0molL-1稀硝酸250mL.需要的玻璃仪器除了有烧杯、量筒、玻璃棒,胶头滴管,还有250mL容量瓶;
(2)Ni和浓硝酸在加热条件下反应生成Ni(NO3)2、NO2和H2O,化学方程式为,Ni+4(浓)HNO3![]() Ni(NO3)2+2NO2↑+2H2O;
Ni(NO3)2+2NO2↑+2H2O;
(3)①根据以上分析,加入试剂x调节溶液的pH约为6主要是使Cr3+、Fe3+完全沉淀,而Ni2+未开始沉淀;
②试剂x的作用是先调节pH约为6,后又要调节pH以得到绿色沉淀即要调到8.9,所以只有NaOH符合,故选C;
(4)①根据滴定,则不加入样品比加入mg产品多消耗氢氧化钠为(V2-V1)×10-3×0.500mol,所以mg产品NH3的物质的量为(V2-V1)×10-3×0.500mol,则NH3的质量分数为![]() ;
;
②适当提高称量产品的质量,数据过大能进一步提高测定准确度,进行平行试验取平均值能进一步提高测定准确度,而用H2SO4溶液替代盐酸、用酚酞替代甲基橙对实验基本没影响,故选AD;
(5)用莫尔法测定Cl-的含量,称量mg产品于锥形瓶中,用25mL水溶解后,需要加入稀硝酸至溶液显弱酸性,再滴入指示剂并用AgNO3标准溶液滴定至终点。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 在25℃时,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数:Kb=![]()
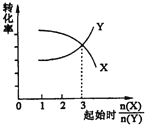
B. 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y)的关系如图所示,则x与Y的反应方程式可表示为:X + 3Y ![]() nZ
nZ
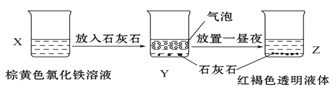
C. 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O= 2Fe(OH)3+3CO2↑+3Ca2+
D. 将10mL 1 molL-1Na2CO3溶液逐滴滴加到10mL 1mol·L-1盐酸中,滴加结束后生成的溶液中有:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应又是离子反应的是
A. 用CO还原氧化铁来炼铁 B. 用锌和稀盐酸反应制氢气
C. 用稀硫酸除铁锈 D. CO2通入澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水时电离方程式为:H3PO2![]() H++H2PO22-
H++H2PO22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据我省中心气象台报道,近年每到春季,我省很多城市多次出现大雾天气。根据物质的分类,雾属于下列分散系中的
A. 胶体 B. 悬浊液 C. 乳浊液 D. 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 浓硝酸应保存于无色试剂瓶中
B. 碘是人体必需的微量元素,所以要多吃富含I2的食物
C. 二氧化硫可广泛用于食品的增白
D. 次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2+3H2 ![]() 2NH3为放热反应,对该反应的下列说法中正确的是 ( )
2NH3为放热反应,对该反应的下列说法中正确的是 ( )
A. N2的能量一定高于NH3
B. H2的能量一定高于NH3
C. 1 mol N2和3 mol H2的总能量一定高于2 mol NH3的总能量
D. 因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将15P原子的电子排布式写成了1s22s22p63s23px23py1,则它违背了( )
A. 能量守恒原理 B. 泡利不相容原理
C. 能量最低原理 D. 洪特规则
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作。
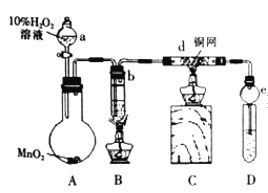
①连接好仪器,检验装置的气密性;
②正确添加试剂;
③点燃C装置中的酒精灯;
④向圆底烧瓶中滴加10%过氧化氢溶液;
⑤点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热。
根据以上所有内容回答下列问题:
(1)装置e的作用是______________;
(2)写出d中发生反应的化学方程式__________________________;
(3)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出化学反应方程式_______________________;
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的实验目的是_________________________。
②当银氨溶液的量为lmL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为_________min。(填范围)
(5)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有___________(填物质名称),要除去该物质,可先在混合液中加入_________(填写下列选项中的字母),然后再通过___________(填操作名称)即可除去。
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com