
【题目】某含C、H、O三种元素的有机物M的相对分子质量小于100,经燃烧分析实验测定该有机物中碳的质量分数为40%,氢的质量分数为6.7%。由此所得结论正确的是( )
A.M的分子式为CH2OB.M的实验式为CH3O
C.M不可能是2-羟基丙酸D.M可能是饱和一元羧酸
【答案】D
【解析】
由未知物中碳的质量分数、氢的质量分数可确定氧的质量分数,根据N=![]() 可计算出该物质中碳、氢、氧原子个数之比,以此解答该题。
可计算出该物质中碳、氢、氧原子个数之比,以此解答该题。
该有机物M中碳的质量分数为40%,氢的质量分数为6.7%,40%+6.7%<100%,说明该有机物中含有O元素,氧的质量分数为1-40%-6.7%=53.3%,则该有机物分子中碳、氢、氧三种元素的原子个数之比N(C):N(H):N(O)=![]() :
:![]() :
:![]() =1:2:1,物质M的实验式为CH2O,因M的相对分子质量小于100,则符合题意的M可能结构为HCHO、CH3COOH、CH3CH(OH)COOH等,分析选项物质,可知只有CH3COOH符合,乙酸是饱和一元羧酸,故正确选项为D。
=1:2:1,物质M的实验式为CH2O,因M的相对分子质量小于100,则符合题意的M可能结构为HCHO、CH3COOH、CH3CH(OH)COOH等,分析选项物质,可知只有CH3COOH符合,乙酸是饱和一元羧酸,故正确选项为D。


科目:高中化学 来源: 题型:
【题目】L-多巴是一种有机物,分子式为C9H11O4N,它可用于帕金森病的治疗,其结构简式为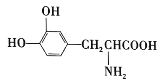 。下列关于L-多巴的叙述不正确的是( )
。下列关于L-多巴的叙述不正确的是( )
A.它属于α-氨基酸,既具有酸性,又具有碱性
B.它能与FeCl3溶液发生显色反应
C.它可以通过两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环
D.它既与酸反应又与碱反应,等物质的量的L-多巴最多消耗的NaOH与HC1的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.能量之间可相互转化:电解食盐水制备氯气是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4 (aq),CuSO4 (aq);铜片,铁片,锌片和导线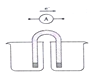
(1)完成原电池甲的装置示意图,并作相应的标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。_____________
(2)以铜片为电极之一,硫酸铜溶液为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极________________
(3)甲乙两种原电池中可更有效地将化学能转化为电能的是____________,其原因是_________________________
(4)根据牺牲阳极的阴极保护法原理,为了减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
Ⅱ. CO与H2反应还可制备C2H5OH,C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
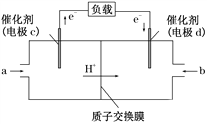
电池总反应为C2H5OH+3O2===2CO2+3H2O,则d电极是________(填“正极”或“负极”),c电极的反应方程式为_______________________________。若线路中转移2 mol电子,则上述燃料电池,消耗的O2在标况下的体积为______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某卤代烃与NaOH的醇溶液共热,产生的气体在标准状况下的体积为896mL,同时得到溶液100mL。取出10mL溶液先用HNO3酸化后再加入AgNO3溶液直到不再产生白色沉淀为止,用去0.1mol·L-1AgNO3溶液40mL;所得气体完全燃烧时消耗O20.18mol。则该有机物的结构简式为________,名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。
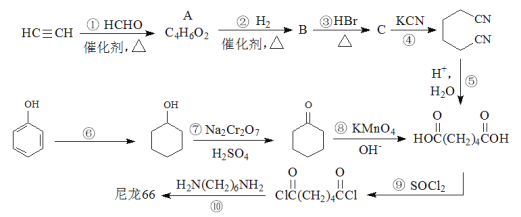
(1)A的结构简式为_____________。
(2)B中官能团的名称是_____________。
(3)反应①~④中,属于加成反应的有_______,反应⑥~⑨中,属于氧化反应的有_______。
(4)请写出反应⑥的化学方程式_____________。
(5)高分子材料尼龙66中含有![]() 结构片段,请写出反应⑩的化学方程式_____________。
结构片段,请写出反应⑩的化学方程式_____________。
(6)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
(7)聚乳酸(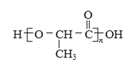 )是一种生物可降解材料,已知羰基化合物可发生下述
)是一种生物可降解材料,已知羰基化合物可发生下述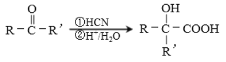 反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机样品(仅含C、H、O三种元素)3.0g在足量O2中完全燃烧,将燃烧后的混合物先通过足量的浓硫酸,浓硫酸增重1.8g,再通过足量的澄清石灰水,经过滤得到10g沉淀。该有机样品的组成可能是(括号内给出的是有机物的分子式)( )
A.葡萄糖(C6H12O6)与蔗糖(C12H22O11)
B.醋酸与甲酸甲酯(C2H4O2)
C.乙醇与甲醛(CH2O)
D.二甲醚(C2H6O)与乳酸(C3H6O3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关橡胶的叙述正确的是( )
A.从废轮胎上刮下的橡胶粉末可溶于有机溶剂
B.天然橡胶的成分是顺式聚异戊二烯![]() ,能溶于汽油
,能溶于汽油
C.天然橡胶![]() 和杜仲胶
和杜仲胶![]() 互为同分异构体
互为同分异构体
D.硅橡胶![]() 属于无机橡胶,是无机高分子化合物
属于无机橡胶,是无机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
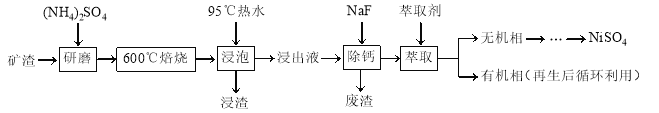
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
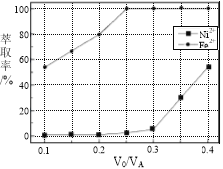
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某恒容密闭容器中加入1.6 mol L-1的NO2后,会发生如下反应:2NO2(g)N2O4(g) △H =-56.9kJmol-1。其中N2O4的物质的量浓度随时间的变化如图所示,下列说法不正确的是
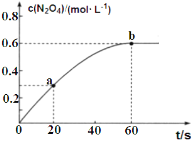
A.升高温度,60s后容器中混合气体颜色加深
B.0-60s内,NO2的转化率为75%
C.0-60s内,v(NO2)=0.02mol L-1 s-1
D.a、b两时刻生成NO2的速率v(a)>v(b)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com