
【题目】向某恒容密闭容器中加入1.6 mol L-1的NO2后,会发生如下反应:2NO2(g)N2O4(g) △H =-56.9kJmol-1。其中N2O4的物质的量浓度随时间的变化如图所示,下列说法不正确的是
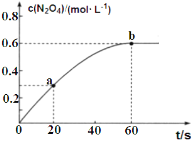
A.升高温度,60s后容器中混合气体颜色加深
B.0-60s内,NO2的转化率为75%
C.0-60s内,v(NO2)=0.02mol L-1 s-1
D.a、b两时刻生成NO2的速率v(a)>v(b)
【答案】D
【解析】
A. 放热反应,温度升高,平衡逆向移动,二氧化氮的量增加,颜色变深,A项正确;
B. 设容器体积为V,0-60s内,生成N2O4的物质的量为0.6Vmol,则消耗的NO2的物质的量为1.2Vmol,NO2的转化率为![]() =75%,B项正确;
=75%,B项正确;
C. 根据图中信息可知,从反应开始到刚达到平衡时间段内![]() =0.01 molL1s1,则v(NO2)=2 v(N2O4)=2×0.01 molL1s1=0.02molL1s1 ,C项正确;
=0.01 molL1s1,则v(NO2)=2 v(N2O4)=2×0.01 molL1s1=0.02molL1s1 ,C项正确;
D. 随着反应的进行,消耗的NO2的浓度越来越小,生成NO2的速率即逆反应速率越来越大,因此a、b两时刻生成NO2的速率:v(a)<v(b),D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】某含C、H、O三种元素的有机物M的相对分子质量小于100,经燃烧分析实验测定该有机物中碳的质量分数为40%,氢的质量分数为6.7%。由此所得结论正确的是( )
A.M的分子式为CH2OB.M的实验式为CH3O
C.M不可能是2-羟基丙酸D.M可能是饱和一元羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+* H)。下列说法错误的是

A.向该反应体系中加入少量的水能增加甲醇的收率
B.带*标记的物质是该反应历程中的中间产物或过渡态
C.二氧化碳加氢制甲醇的过程中原子利用率达100%
D.第③步的反应式为*H3CO+ H2O→CH3OH+*HO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解过程。下列有关说法不正确的是( )

A.M与A均能使酸性高锰酸钾溶液和溴水退色
B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应
C.![]() 与热的烧碱溶液反应,最多可消耗
与热的烧碱溶液反应,最多可消耗![]()
D.A、B、C各![]() 分别与足量金属钠反应,放出的气体的物质的量之比为1∶2∶2
分别与足量金属钠反应,放出的气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)铜原子有 _____种不同运动状态的电子,亚铜离子的价电子排布式为:_____。
(2)铜能与类卤素(CN)2 反应生成 Cu(CN)2,1 mol (CN)2 分子中含有π键的数目为____,C、N 两元素可形成的离子 CN-,该离子的结构式为_____,请写出 CN-的一种等电子体_____(写化学式)。
(3)CuCl2 溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2 ]2+(En 是乙二胺的简写),结构如图所示
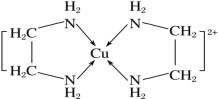
已知配合物的中心粒子的配位数指配位原子总数,则 Cu2+的配位数为_________, 该配离子中所含的非金属元素的电负性由小到大的顺序是_____;乙二胺分子中氮原子轨道的杂化类型为____,乙二胺(En)和三甲胺 [N(CH3)3 ]均属于胺类,相对分子质量相近,但乙二胺的沸点却比三甲胺的沸点高得多,其原因是:_____。
(4)某 M 原子的外围电子排布式为 3s23p5,铜与 M 形成化合物的晶胞如图所示
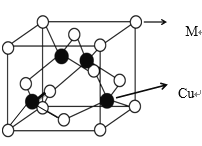
①已知铜和 M 的电负性分别为 1.9 和 3.0,则铜与 M 形成的该种化合物属于__________(填“离子”或“共价”)化合物,其化学式为__________。
②铜和形成的晶体中每个 M 原子周围最近等距的铜原子数目为_____。
③已知该晶体的晶胞参数(即立方体晶胞的棱长)为 acm,则该晶体中两个相距最近的 M 原子之间的核间距为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:
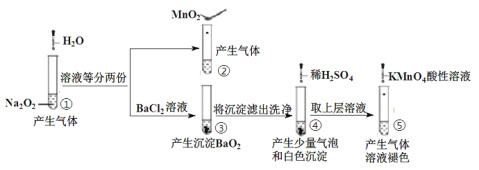
已知:H2O2H++HO2-;HO2-H++O22-
下列分析不正确的是
A.①、④实验中均发生了氧化还原反应和复分解反应
B.①、⑤中产生的气体能使带火星的木条复燃,说明存在H2O2
C.③和④不能说明溶解性:BaO2>BaSO4
D.⑤中说明H2O2具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应速率和化学平衡、溶液pH影响的图像,其中图像和实验结论表达均正确的是

A.①是其他条件一定时,反应速率随温度变化的图像,正反应△H<0
B.②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是表示Cl2通入H2S溶液中pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图1是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。请写出NO2和CO反应的热化学方程式:________________。
(2)观察图a和图b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系。图a:________________________;图b:_________________________。
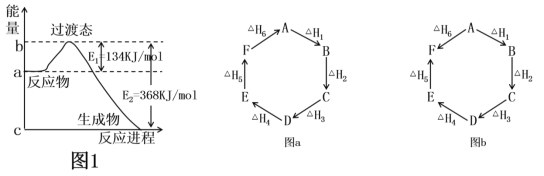
(3)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:① H2O(l)=H2O(g) △H=+44 kJ/mol
② 2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) △H= +1160 kJ/mol
③ CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ/mol
请写出CH4(g)与NO2(g)反应生成参与大气循环的气体和液态水的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol·L-1NaOH溶液中逐滴滴加0.2 mol·L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是
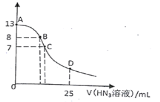
A. 0.1 mol·L-1 NaN3溶液pH约为8.85
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)<12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com