
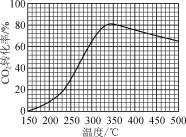
【题目】恒压下,将CO2和H2以体积比1∶4混合进行反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
A.反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH>0
B.图中450 ℃时,延长反应时间无法提高CO2的转化率
C.350 ℃时,c(H2)起始=0.4 mol·L-1,CO2平衡转化率为80%,则平衡常数K<2 500
D.当温度从400 ℃升高至500 ℃,反应处于平衡状态时,v(400℃)逆>v(500℃)逆
【答案】BC
【解析】
如图所示为用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况,约350℃之前,反应还未达到平衡态,CO2转化率随温度升高而增大,约350℃之后,反应达到化学平衡态,CO2转化率随温度升高而减小,由此可知该反应为放热反应。
A.由分析可知该反应为放热反应,则ΔH<0,故A错误;
B.图中450 ℃时,反应已达平衡态,则延长反应时间无法提高CO2的转化率,故B正确;
C.350 ℃时,设起始时容器的容积为V,c(H2)起始=0.4 mol·L-1,则n(H2)起始=0.4 Vmol,CO2平衡转化率为80%,可列三段式为:
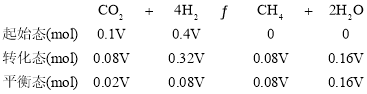
根据阿伏伽德罗定律有![]() ,平衡时的体积为V(平衡)=
,平衡时的体积为V(平衡)= ![]() ,则平衡时
,则平衡时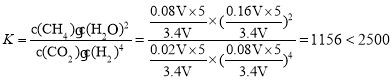 ,故C正确;
,故C正确;
D.温度升高,正逆反应速率均加快,则v(400℃)逆<v(500℃)逆,故D错误;
综上所述,答案为BC。


科目:高中化学 来源: 题型:
【题目】据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可轻易制备出超高强度和超高耐久性能的高性能混凝土。关于二氧化硅下列说法中正确的是( )
A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物
B.二氧化碳通入硅酸钠溶液中可以得到硅酸
C.由CaCO3+SiO2![]() CaSiO3+CO2↑可知硅酸的酸性比碳酸强
CaSiO3+CO2↑可知硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O 于 40~45℃熔化,48℃分解;
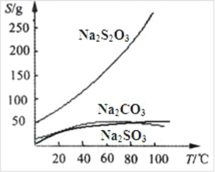
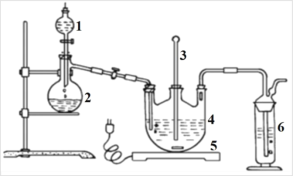
Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。
Ⅰ.现按如下方法制备Na2S2O3·5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为_____________,装置6中可放入_____________。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2 ② Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通入SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O 并测定含量:

(3)从热的反应混合液中获得 Na2S2O3·5H2O粗晶体,需经过下列实验步骤,请选择正确的选项:热的反应混合液→活性炭脱色并保温→________→________→________→________→获得Na2S2O3·5H2O粗晶体。
a.用冰水浴冷却结晶,抽滤; b.用少量水洗涤晶体、烘干;
c.80℃蒸发浓缩滤液至溶液表面出现晶膜; d.用乙醇洗涤晶体、晾干;
e.45℃蒸发浓缩滤液至溶液呈微黄色浑浊; f.趁热过滤。
(4)制得的粗晶体中往往含有少量杂质。为了测定粗产品中 Na2S2O3·5H2O的含量, 一般采用在酸性条件下用 KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.280 g的粗样品溶于水,用 0.4000 mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32-全部被氧化时,消耗 KMnO4溶液体积20.00 mL。 试回答:
①对于上述实验操作,下列说法正确的是_____。
A.用电子天平称量粗样品时,若电子天平未进行调平,则纯度偏高
B.装 KMnO4标准液的酸式滴定管洗涤后若未润洗,则纯度偏高
C.滴定至锥形瓶内溶液刚好由无色变为浅红色立即进行读数,则纯度偏高
D.滴定时若滴定速度过慢或摇晃锥形瓶过于剧烈,则纯度偏高
②产品中Na2S2O3·5H2O的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是(______)
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是(______)
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),生成物的颜色为___,请写出该反应的化学方程式___。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为___,若有0.5molNa氧化生成氧化钠和过氧化钠的混合物,转移电子的数目为___。
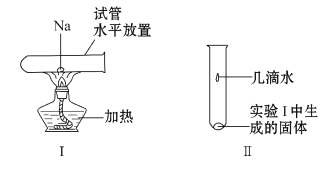
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的衍生物A的化学式为C6H12O2,已知:

又知D不与Na2CO3反应,C和E均不能发生银镜反应,则A的结构可能有( )
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种应用于临床的抗肿瘤药物,其合成路线如下:
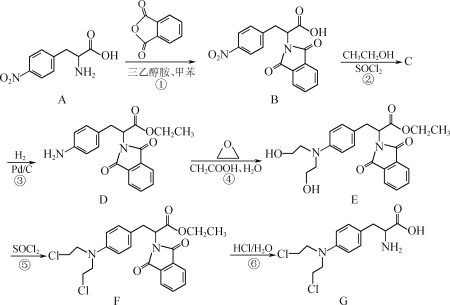
(1) A中的含氧官能团名称为________和________。
(2) C的分子式为C19H16N2O6,写出C的结构简式:________。
(3) 合成路线中,设计①和⑥两个步骤的目的是________________。
(4) G的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①含有苯环,且苯环上有3个取代基;② 分子中含有2个手性碳原子;③ 能发生水解反应,水解产物之一是α氨基酸,另一水解产物分子中只有3种不同化学环境的氢。
(5) 已知: (R、R1代表烃基或H,R2代表烃基)。写出以
(R、R1代表烃基或H,R2代表烃基)。写出以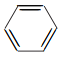 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图___________________(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图___________________(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦锑酸钠(NaSbO3·3H2O)可用于搪瓷的乳白剂及铁皮、钢板的抗酸漆。一种利用高砷锑烟灰(主要成分为Sb2O3、As2O3,还含Ag、Cu、Fe的氧化物)生产焦锑酸钠的工艺流程如下:
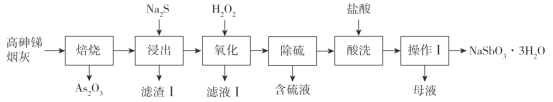
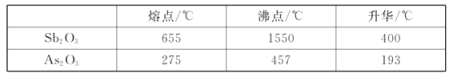
已知:i.Sb2O3、As2O3部分性质如下表:
ii.Ag、Cu、Fe的氧化物不溶于Na2S溶液
iii.Na2SbO4不溶于水;NaSbO3﹒3H2O既不溶于水,也不溶于酸。
请回答下列问题:
(1)“焙烧”的最低温度为_________(填标号)
a.655℃ b.400℃ c.275℃ d.193℃
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是_________________________________________。“浸出”时,Sb2O3转化为Na3SbS3的化学方程式为__________________________________________,滤渣Ⅰ是____________。
(3)“氧化”时所用H2O2的电子式为___________,氧化产物为Na3SbO4和____________.
(4)“酸洗”的作用是______________________。(用化学方程式表示)
(5)As2O3对应的酸为H3AsO3,测得某工业酸性废液中含H3AsO3和Fe2+,其浓度如表:

已知:iV.Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21。
V.H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用______________方法除去该废水中的砷,除去砷后的废液中c(AsO43-)=__________________(不考虑反应过程中溶液体积的微小变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如图,其总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是
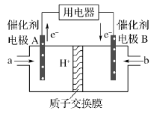
A. 电极A是负极,发生氧化反应
B. 电池工作时,电解液中的H+通过质子交换膜向B电极迁移
C. 放电前后电解质溶液的pH不变
D. b物质在电极上发生的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com