
分析 根据溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,阳离子为H+和Fe2+.根据原子守恒和得失电子总数相等计算.
解答 解:既然还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu.
而Cu可以残留说明溶液中没有Fe3+,阳离子为H+和Fe2+,反应有:CuO+2H+═Cu2++H2O、Fe2O3+6H+═2Fe3++3H2O,、Fe+2Fe3+═3Fe2+、Fe+Cu2+═Fe2++Cu、Fe+2H+═Fe2++H2↑,
根据原子守恒和得失电子总数相等计算,设原有Fe为xmol,Fe2O3为ymol,CuO为zmol,
生成Cu为:$\frac{0.64g}{64g/mol}$=0.01mol,
生成H2为:$\frac{0.448L}{22.4L/mol}$=0.02mol,
根据得失电子总数相等知:2x=2y+2×0.01+2×0.02;
又根据Cl-知:2(x+2y)+0.2×0.200=0.07×4.0,
将上述两式联立解出:x=0.06,y=0.03,
原混合物中氧化铁的质量为:160g/mol×0.03mol=4.8g,
故答案为:4.8g.
点评 本题考查混合物反应的计算,题目难度中等,本题注意从溶液存在的离子判断物质反应的程度,利用守恒的方法计算,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| 序号 | 35mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2g Na2CO3 | 20.0 | 25.1 |
| A. | Na2CO3溶液与盐酸的反应是吸热反应 | |
| B. | NaHCO3溶液与盐酸的反应是放热反应 | |
| C. | 20.0℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1℃ | |
| D. | 20.0℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | W的原子序数可能是Y的两倍 | |
| B. | Z的原子半径比X的大 | |
| C. | Y元素的非金属性比Z元素的强 | |
| D. | Z的最高价氧化物对应的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
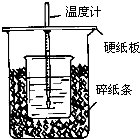 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
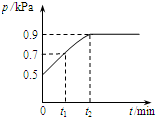 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | t1时n(X)=0.04 mol | |
| B. | t1到t2,混合气体的平均相对分子量增大 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com