
【题目】KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
(1)浓盐酸在反应中显示出来的性质是__________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.3mol Cl2,则转移的电子的物质的量为__________mol。
(3)氧化剂是__________,氧化产物是__________。
(4)![]() ,该反应的还原产物是__________;_________元素被氧化;若反应有
,该反应的还原产物是__________;_________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
【答案】② 0.5 KClO3 Cl2 ClO2 碳 10
【解析】
(1)反应中一部分HCl中Cl从-1价升高到0价,失去电子,发生氧化反应;
(2)根据方程式可知,生成3mol Cl2电子转移5mol,据此计算;
(3)反应中HCl中Cl从-1价升高到0价,失去电子,发生氧化反应,HCl作还原剂,KClO3中Cl从+5价降低到0价,得到电子,发生还原反应,KClO3作氧化剂,Cl2既是氧化产物又是还原产物;
(4)反应中KClO3中Cl从+5价降低到+4价,得到电子,发生还原反应,H2C2O4中C从+3价升高到+4价,失去电子,发生氧化反应,生成2molClO2电子转移2mol,据此分析判断。
(1)反应中HCl中Cl从-1价升高到0价,失去电子,发生氧化反应,其中一部分HCl作还原剂,表现还原性,另一部分生成盐溶液,体现酸性,选择②;
(2)生成3mol Cl2电子转移5mol,那么产生0.3mol Cl2,转移的电子的物质的量为0.5mol;
(3)反应中HCl中Cl从-1价升高到0价,失去电子,发生氧化反应,HCl作还原剂,KClO3中Cl从+5价降低到0价,得到电子,发生还原反应,KClO3作氧化剂,Cl2既是氧化产物又是还原产物,因此氧化剂是KClO3,氧化产物是Cl2;
(4)反应中KClO3中Cl从+5价降低到+4价,得到电子,发生还原反应,ClO2是还原产物;H2C2O4中C从+3价升高到+4价,失去电子,发生氧化反应,被氧化;生成2molClO2电子转移2mol,当反应有![]() 电子发生转移时,被还原的氧化剂是10mol。
电子发生转移时,被还原的氧化剂是10mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱) 下列有关说法正确的是

A. “氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B. “过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C. “还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期的三种元素甲、乙、丙,原子序数依次增大,且原子核外都有1个未成对电子,下列说法错误的是
A.金属性:甲>乙>丙B.三种元素的单质都能与水反应
C.离子半径:甲>乙>丙D.最高价氧化物对应水化物可两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头表示配位键)。下列说法不正确的是( )
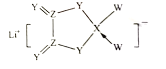
A.W的非金属性比Y的强
B.该物质中X原子满足8电子稳定结构
C.该物质中含离子键和共价键
D.Z的氧化物都易溶于水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取
(连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取![]() 的方法很多,
的方法很多,
(1)在碱性溶液中用![]() 还原
还原![]() 法制备
法制备![]() 的反应原理为:
的反应原理为:![]() (未配平)反应装置如图所示:
(未配平)反应装置如图所示:
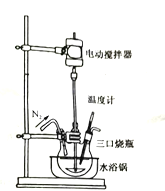
①实验开始及整个过程中均需通入![]() ,其目的是__________________________________。
,其目的是__________________________________。
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是______________________。
③为使![]() 尽可能完全被还原,加入三口烧瓶中的反应液,应控制
尽可能完全被还原,加入三口烧瓶中的反应液,应控制![]() ______________。
______________。
(2)用![]() 还原
还原![]() 制备
制备![]() 的装置(夹持加热仪器略)如下:
的装置(夹持加热仪器略)如下:
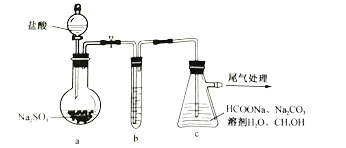
①装置a烧瓶中发生反应的化学方程式为_________________________________。
②装置b用于净化![]() ,适宜的试剂是______________________________。
,适宜的试剂是______________________________。
③装置c在70~83℃生成![]() 并析出,同时逸出
并析出,同时逸出![]() ,该反应的化学方程式为________________________,加入
,该反应的化学方程式为________________________,加入![]() 的目的是________________________;利用反应后的浊液分离提纯
的目的是________________________;利用反应后的浊液分离提纯![]() 需经过的操作为_____________________________________________________。
需经过的操作为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
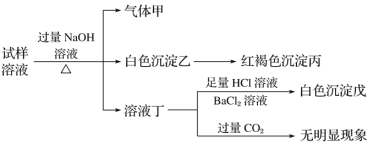
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定有NH4+、SO42-和Fe2+
B.试样中一定没有Al3+
C.若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断溶液中还有Cl-
D.该盐工业上可以用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
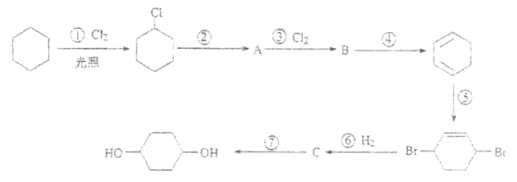
(1)写出反应④、⑦的化学方程式:
④__________________________________;
⑦__________________________________。
(2)上述七个反应中属于加成反应的有____________(填反应序号),A中所含有的官能团名称为____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质及其化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(1)推断各符号所代表的物质的化学式:
A____,B___,C____,D____,E____。
(2)分别写出反应①、④、⑥的化学方程式:
①_____ ④_____, ⑥_____。
(3)写出反应②的离子方程式 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com