
【题目】![]() (连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取
(连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取![]() 的方法很多,
的方法很多,
(1)在碱性溶液中用![]() 还原
还原![]() 法制备
法制备![]() 的反应原理为:
的反应原理为:![]() (未配平)反应装置如图所示:
(未配平)反应装置如图所示:
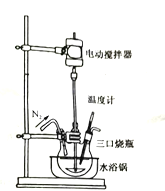
①实验开始及整个过程中均需通入![]() ,其目的是__________________________________。
,其目的是__________________________________。
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是______________________。
③为使![]() 尽可能完全被还原,加入三口烧瓶中的反应液,应控制
尽可能完全被还原,加入三口烧瓶中的反应液,应控制![]() ______________。
______________。
(2)用![]() 还原
还原![]() 制备
制备![]() 的装置(夹持加热仪器略)如下:
的装置(夹持加热仪器略)如下:
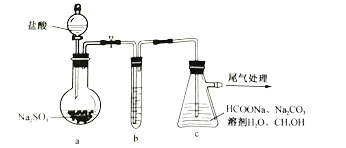
①装置a烧瓶中发生反应的化学方程式为_________________________________。
②装置b用于净化![]() ,适宜的试剂是______________________________。
,适宜的试剂是______________________________。
③装置c在70~83℃生成![]() 并析出,同时逸出
并析出,同时逸出![]() ,该反应的化学方程式为________________________,加入
,该反应的化学方程式为________________________,加入![]() 的目的是________________________;利用反应后的浊液分离提纯
的目的是________________________;利用反应后的浊液分离提纯![]() 需经过的操作为_____________________________________________________。
需经过的操作为_____________________________________________________。
【答案】排出装置内空气,使反应在无氧状况下进行 使反应液均匀受热 小于8:1(或<8) ![]() 饱和
饱和![]() 溶液
溶液 ![]() 降低
降低![]() 的溶解度 过滤、洗涤、重结晶、过滤、干燥
的溶解度 过滤、洗涤、重结晶、过滤、干燥
【解析】
(1)①![]() 在空气中极易被氧化,通入
在空气中极易被氧化,通入![]() 其目的是排出装置内空气;
其目的是排出装置内空气;
②采用水浴加热的主要优点是使反应液均匀受热;
③![]() ,根据得失电子守恒可知,
,根据得失电子守恒可知,![]() =8;
=8;
(2)①装置a烧瓶中发生Na2SO3与盐酸反应生成SO2的反应;
②生成的SO2气体中含有HCl气体,根据性质选择除杂溶液;
③装置c在70~83℃![]() 和
和![]() 、
、![]() 反应生成
反应生成![]() 并析出,同时逸出
并析出,同时逸出![]() ;
;![]() 不溶于甲醇,加入
不溶于甲醇,加入![]() 可降低
可降低![]() 的溶解度;利用反应后的浊液分离提纯
的溶解度;利用反应后的浊液分离提纯![]() 需重结晶。
需重结晶。
(1)①![]() 在空气中极易被氧化,实验开始及整个过程中均需通入
在空气中极易被氧化,实验开始及整个过程中均需通入![]() ,其目的是排出装置内空气,使反应在无氧状况下进行;
,其目的是排出装置内空气,使反应在无氧状况下进行;
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是使反应液均匀受热;
③根据得失电子守恒配平方程式,![]() ,
,![]() =8,为使
=8,为使![]() 尽可能完全被还原,加入三口烧瓶中的反应液,应控制
尽可能完全被还原,加入三口烧瓶中的反应液,应控制![]() <8;
<8;
(2)①装置a烧瓶中发生反应的化学方程式为![]() ;
;
②生成的SO2气体中含有HCl气体,除杂适宜的试剂是饱和![]() 溶液;
溶液;
③装置c在70~83℃生成![]() 并析出,同时逸出
并析出,同时逸出![]() ,化学方程式为
,化学方程式为![]() ;
;![]() 不溶于甲醇,加入
不溶于甲醇,加入![]() 的目的是降低
的目的是降低![]() 的溶解度;利用反应后的浊液分离提纯
的溶解度;利用反应后的浊液分离提纯![]() 需经过的操作为过滤、洗涤、重结晶、过滤、干燥。
需经过的操作为过滤、洗涤、重结晶、过滤、干燥。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并检验氯气的氧化性,同时用电解产生的H2还原CuO粉末来测定Cu的相对原子质量。

(1)写出电解饱和食盐水的离子方程式_________________________________。
(2)为完成上述实验,正确的连接顺序为A连_______;B连_______ (填写导管口字母)。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是下列试剂中的___________。
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.亚硫酸钠溶液 d.氯化亚铁溶液
(4)丙装置的c瓶中盛放的试剂为___________,作用是______________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定U型管b反应前后的质量变化,得到生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:___________方案所测结果更准确。若按合理方案测定的数据计算,Cu的相对原子质量为________________。
②不合理的方案会造成测定结果___________(填“偏低、偏高或无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。
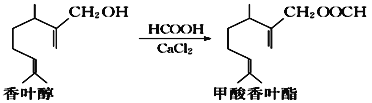
下列说法中正确的是( )
A.香叶醇的分子式为C11H18O
B.香叶醇、甲酸香叶酯均可与钠发生置换反应生成H2
C.1 mol甲酸香叶酯可以与2 mol H2发生加成反应
D.甲酸香叶酯可使溴的四氯化碳溶液和酸性KMnO4溶液褪色,褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。下列说法正确的是

A.溶液中一定不含有的溶质是MgCl2、NH4Cl
B.溶液中可能含有的溶质是KCl、Na2CO3
C.溶液中一定含有的溶质是HCl、AlCl3、NH4Cl
D.AB段发生反应的离子方程式为Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列流程回答:
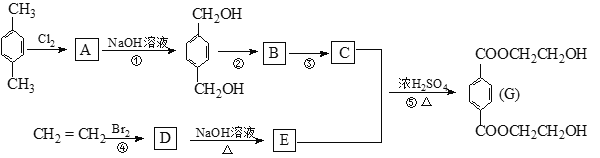
(1) 写出结构简式 C______ E_________。
(2)指出反应类型: ① ___________ ③ _____________ ⑤ ____________
(3)写出化学方程式 C + E ![]() G____________
G____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
(1)浓盐酸在反应中显示出来的性质是__________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.3mol Cl2,则转移的电子的物质的量为__________mol。
(3)氧化剂是__________,氧化产物是__________。
(4)![]() ,该反应的还原产物是__________;_________元素被氧化;若反应有
,该反应的还原产物是__________;_________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的混合物投入100ml盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
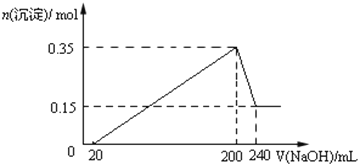
(1)原混合物中镁和铝的质量比为_______
(2)NaOH溶液的物质的量浓度为_______ molL﹣1
(3)生成的气体在标准状况下的体积为_______ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知溴乙烷(C2H5Br)是无色液体,沸点38.4℃,密度比水大,难溶于水,可溶于多种有机溶剂。在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了如图所示的装置,用KMnO4酸性溶液是否褪色来检验生成的气体是否是乙烯。
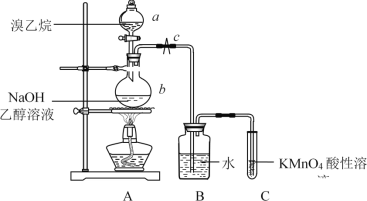
请回答下列问题:
(1)仪器a的名称为__________。
(2)实验前应检测装置A的气密性。方法如下:关闭止水夹c,由仪器a向仪器b中加水,若______________________________,则证明装置A不漏气。
(3)仪器b中发生反应的化学方程式为______________________________。
(4)反应开始一段时间后,在装置B底部析出了较多的油状液体,若想减少油状液体的析出,可对装置A作何改进?__________________________________________________
(5)装置A中产生的气体通入装置C之前要先通过装置B,装置B的作用为__________________。
(6)检验乙烯除用KMnO4酸性溶液外还可选用的试剂有__________,此时,是否还有必要将气体先通过装置B?__________(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com