
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=_____________________。降低温度,该反应K值____________,二氧化硫转化率____________,化学反应速率___________。(以上均填“增大”“减小”或“不变”)
(2)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是_______________________________________________。
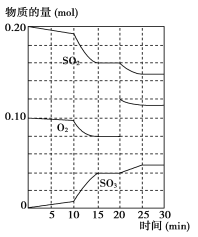
(3据上图判断,反应进行至20 min时,曲线发生变化的原因是_______________________(用文字表达);10 min到15 min的曲线变化的原因可能是__________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?_________(填“是”或“否”)。此时,化学反应速率是v(正)_______v(逆)(填“>”、“<”或“=”),原因是________________________________________________________________________________。
2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?_________(填“是”或“否”)。此时,化学反应速率是v(正)_______v(逆)(填“>”、“<”或“=”),原因是________________________________________________________________________________。
【答案】![]() 增大增大减小15~20 min和25~30 min)增加了O2的量bc否>Qc =
增大增大减小15~20 min和25~30 min)增加了O2的量bc否>Qc = ![]() = 17.8 < K,反应向正反应方向移动
= 17.8 < K,反应向正反应方向移动
【解析】
(1) 化学平衡常数是反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度的幂指数乘积的比;该反应正方向放热,降低温度,反应速率降低、平衡正向移动;(2)根据平衡时浓度保持不变分析;(3)根据影响平衡移动的因素分析;(4)根据Qc 与K的关系分析。![]()
(1) 化学平衡常数是反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度的幂指数乘积的比,对该反应来说,其化学平衡常数表达式K=![]() ;由于该反应的正反应是放热反应,所以降低温度,平衡正向移动,该反应K值增大;二氧化硫转化率增大;降低温度,化学反应速率减小;(2)600 ℃时若反应处于平衡状态,则各种物质的物质的量浓度不变,由体积图像可知,达到平衡状态的时间段是15~20 min和25~30 min; (3)据上图判断,反应进行至20 min时,SO2物质的量减小,O2物质的量增大;SO3物质的量增大,发生上述变化的原因是增加了O2的量,使平衡正向移动。在10 min到15 min时SO2和O2物质的量减小;SO3物质的量增大,平衡正向移动,由于该反应的正反应是气体体积减小的放热反应,所以要使平衡正向移动,改变的因素可能是缩小容器体积而使体系的压强增大,或降低温度。因此选项为b、c。(4)Qc =
;由于该反应的正反应是放热反应,所以降低温度,平衡正向移动,该反应K值增大;二氧化硫转化率增大;降低温度,化学反应速率减小;(2)600 ℃时若反应处于平衡状态,则各种物质的物质的量浓度不变,由体积图像可知,达到平衡状态的时间段是15~20 min和25~30 min; (3)据上图判断,反应进行至20 min时,SO2物质的量减小,O2物质的量增大;SO3物质的量增大,发生上述变化的原因是增加了O2的量,使平衡正向移动。在10 min到15 min时SO2和O2物质的量减小;SO3物质的量增大,平衡正向移动,由于该反应的正反应是气体体积减小的放热反应,所以要使平衡正向移动,改变的因素可能是缩小容器体积而使体系的压强增大,或降低温度。因此选项为b、c。(4)Qc = ![]() = 17.8 < K,所以没有达到平衡状态,反应向正反应方向移动,v(正)>v(逆)。
= 17.8 < K,所以没有达到平衡状态,反应向正反应方向移动,v(正)>v(逆)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式为N2H4+2H2O2=N2↑+4H2O。下列说法中错误的是 ( )
A. 肼(N2H4)分子中只存在极性共价键
B. 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
C. 该反应中肼作还原剂
D. 该反应的反应物总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学方程式SiO2+3C![]() SiC+2CO↑,有关叙述正确的是
SiC+2CO↑,有关叙述正确的是
A. 反应中SiO2是氧化剂,C是还原剂
B. 硅元素被还原了,碳元素被氧化了
C. 在反应中C既是氧化剂又是还原剂
D. 在反应中氧化剂与还原剂的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生物电化学方法脱除水体中NH4+的原理如下图所示:
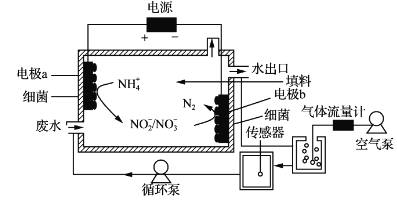
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中包含的信息分析,下列叙述正确的是 ( )
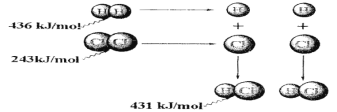
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA (g) +nB (g)![]() pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为____热反应,且m+n____p (填“>”、 “=” 、“<”)。
(2)减压时,A的质量分数______.(填“增大”、“减小”或“不变”,下同)
(3)若加入B (体积不变),则A的转化率_____,B的转化率_________。
(4)若升高溫度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________。
(6)若B是有色物质,A、C均无色,则加入C (体积不变)时混合物颜色______,而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、 “变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的说法正确的是( )
A.羧酸与醇形成的酯都是油脂
B.油脂分为油和脂肪,它们是同系物
C.天然油脂都是单甘油酯
D.植物油兼有酯类和烯烃的性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com