
【题目】下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
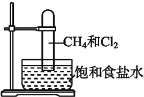
A. 此反应无光照也可发生
B. 盛放饱和食盐水的水槽底部会有少量晶体析出
C. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属单质及化合物有广泛的应用。
(1)已知锂离子电池总反应方程式是FePO4(s)+Li(s) ![]() LiFePO4(s)。请写出Fe3+的电子排布式____________,PO43-离子中p原子杂化轨道类型____________。
LiFePO4(s)。请写出Fe3+的电子排布式____________,PO43-离子中p原子杂化轨道类型____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
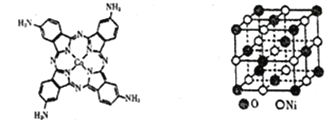
①一个电子的运动状态取决于______种因素,基态Co原子中空间运动状态不同的电子数为___种。
②氨基钴酞菁中非金属元素的电负性从大到小的顺序为_________
③“氨基钴酞菁”比“钴酞菁”显著溶于水,请简述其原因_______。
(3)K3[Co(NO2)6]中存在的化学键类型有____________,配位数为_______。
(4)Sr和Ca为同族金属元素,CaO与SrO熔点更高、硬度更大,请简述原因______。
(5)如上图所示为NiO晶体的晶胞示意图:
①该晶胞中与一个Ni最近等距离的O构成的空间几何形状为____________________。
②在NiO晶体中Ni2+的半径为apm,O3-的半径为bpm,假设它们在晶体中是紧密接触的,则其密度为___g/cm3。(用含字母a、b的计算式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法中正确的是
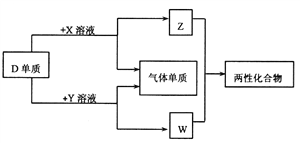
A. 离子半径:C+>D3+>B2-
B. C的单质的熔点低于D的单质的熔点
C. 电解C、E形成的化合物水溶液可生成C、E对应的单质
D. 由A、B、E形成的化合物都含有共价键,溶液都呈强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=_____________________。降低温度,该反应K值____________,二氧化硫转化率____________,化学反应速率___________。(以上均填“增大”“减小”或“不变”)
(2)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是_______________________________________________。
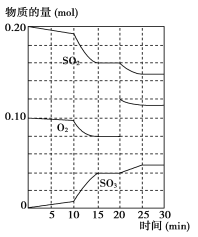
(3据上图判断,反应进行至20 min时,曲线发生变化的原因是_______________________(用文字表达);10 min到15 min的曲线变化的原因可能是__________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?_________(填“是”或“否”)。此时,化学反应速率是v(正)_______v(逆)(填“>”、“<”或“=”),原因是________________________________________________________________________________。
2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?_________(填“是”或“否”)。此时,化学反应速率是v(正)_______v(逆)(填“>”、“<”或“=”),原因是________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质。
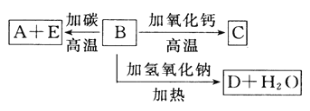
请填空:
(1)形成单质A的原子的结构示意图为______,它的最高化合价为______。
(2)B的化学式(分子式)为______,B和碳反应生成A和E的化学方程式是____________。
(3)C的化学式(分子式)为___________,D的化学式(分子式)为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
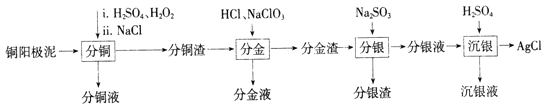
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
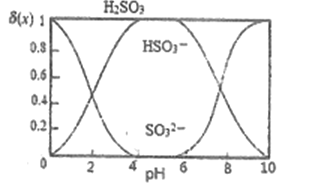
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D均含有同一种元素,A为单质,根据下图所示的物质之间的转化关系,回答下列有关问题。
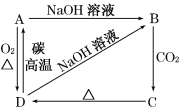
①写出A、B、C、D各物质的名称:A________,B________,C________,D_______;
②写出A→D的化学方程式:_______________。
③写出下列变化的离子方程式:
B→C______________________________;
D→B______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国庆70周年大典上,放飞的气球由可降解材料制作,内充的气体是比氢气安全的氦气。下列关于氦的说法正确的是( )
A.氦气比氢气活泼B.氦气的密度比空气大
C.氦气的分子式为He2D.氦原子最外层电子数为2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com