
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是__________________。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:负极的电极反应式是_______________________________________ 。
(3)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
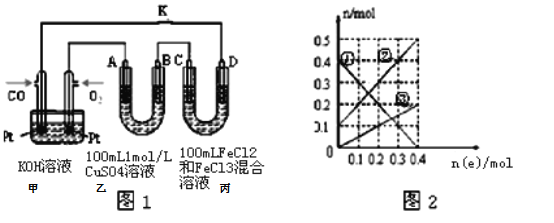
①写出通入CO的电极反应式____________________________________
②乙中B极产生的气体在标准状况下的体积为_____________.
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是____________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要_____________mL 8.0mol·L﹣1 NaOH溶液。
【答案】 (N2H4(1)+O2(g)===N2(g)+2H2O(l) △H= -624.0kJ/mol N2H4+4OH--4e-=4H2O+N2↑ CO -2e - + 4OH - = CO32-+ 2H2O 2.24 L Cu 2+ 175
【解析】(1)32.0g N2H4的物质的量=![]() =1mol,1mol肼完全燃烧生成液态水放出624kJ热量,该热化学反应方程式为N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-624kJ/mol,故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-624kJ/mol;
=1mol,1mol肼完全燃烧生成液态水放出624kJ热量,该热化学反应方程式为N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-624kJ/mol,故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-624kJ/mol;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,故答案为:N2H4+4OH--4e-=4H2O+N2↑;
(3)①CO燃料电池是原电池反应,CO在负极失电子发生氧化反应生成碳酸根离子,电极反应为:CO -2e - + 4OH - = CO32-+ 2H2O,故答案为:CO -2e - + 4OH - = CO32-+ 2H2O;
②工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出后,氢离子得到电子生成氢气,设生成气体物质的量为xmol,溶液中铜离子物质的量为0.1mol,电极反应为:Cu2++2e-=Cu,0.1mol Cu2+放电转移0.2mol电子,随后发生2H++2e-=H2↑,生成xmol H2转移2xmol电子;A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,生成xmol O2转移4xmol电子;根据得失电子守恒得到0.2+2x=4x,解得x=0.1mol,乙中B极析出的气体是氢气,物质的量为0.1mol,在标准状况下的体积为2.24L,故答案为:2.24L;
③根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,故①为Fe3+,②为Fe2+,③为Cu2+;由图可知电子转移为0.4mol,生成Cu2+物质的量为0.2mol,阴极电极反应Fe3++e-=Fe2+,反应结束后,溶液中有Fe2+为0.5mol,Cu2+为0.2mol,所以需要加入NaOH溶液0.5×2+0.2×2=1.4mol,所以所需NaOH溶液的体积为![]() =0.175L=175mL,故答案为:Cu2+;175。
=0.175L=175mL,故答案为:Cu2+;175。


科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.同温同压下,气体的体积之比等于它们的物质的量之比
B.同温同压下,气体的体积之比等于它们的质量之比
C.同温同压下,相同体积的气体的质量之比等于它们的相对分子质量之比
D.同温同压下,气体的密度之比等于它们的相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是

A. 电极a为电池的正极
B. 电极b上发生的电极反应为:O2+2H2O+4e![]() =" 4" OH
=" 4" OH![]()
C. 电路中每流过4mol电子,电池内部释放632kJ热能
D. 每17gH2S参与反应,有1mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 不能自发进行的氧化还原反应,一般可以通过电解实现
B. 电解质溶液导电是化学变化,金属导电是物理变化
C. 电解、电离、原电池均需要通电
D. 电解池和原电池中均发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.同温同压下,气体的体积之比等于它们的物质的量之比
B.同温同压下,气体的体积之比等于它们的质量之比
C.同温同压下,相同体积的气体的质量之比等于它们的相对分子质量之比
D.同温同压下,气体的密度之比等于它们的相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组选用酸性高锰酸钾溶液和草酸溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:[实验内容及记录]
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
mol/L H2C2O4溶液 | H2O | 0.05mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
请回答:
(1)[实验原理] _________________________________________(写离子方程式)
(2)为完成实验目的,H2C2O4溶液的物质的量浓度不低于__________________
(3)根据上表中的实验数据,可以得到的结论是_______________________________
(4)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=______ 。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。

①该小组同学提出的假设是_________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||||
_____mol/L H2C2O4溶液 | H2O | 0.05mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||||
4 | 3.0 | 1.0 | 4.0 | 2.0 | t | |||
③若该小组同学提出的假设成立,应观察到的现象是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下四种有机溶剂: ①四氯化碳 ②苯 ③酒精 ④醋酸,其中可作萃取碘水中碘的萃取剂为
A. ①和③ B. ①②③④ C. ①和② D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,由酸(HM)及其盐(NaM)组成的混合溶液,起始浓度均为lmol·L-1。向该溶液中通入HC1气体或加入NaOH固体时,溶液pH的变化曲线如图所示。下列说法不正确的是

A. C点时,溶液中 c(Na+)=c(M-)
B. 将 D、E 点溶液混合后,c(M-)+c(HM)=2c(Na+)
C. B点时,溶液中 c(M-)>c(Na+)>c(HM)
D. A、B、C三点所表示的溶液中水电离出来的c(H+)逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com