
分析 (1)氮族元素的外围电子为其最外层上s、p能级电子;基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,据此判断键角;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为 2+$\frac{5-1-2×2}{2}$=2,根据价层电子对互斥理论判断原子杂化方式;
(4)①分子晶体中含有氢键的物质熔沸点较高;
②NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示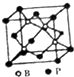 ,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个B原子连接4个P原子,则硼原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的 $\frac{1}{4}$,据此计算.
,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个B原子连接4个P原子,则硼原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的 $\frac{1}{4}$,据此计算.
解答 解:(1)氮族元素的外围电子为其最外层上s、p能级电子,则氮族元素外围电子排布式为ns2np3;基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,所以有9个轨道,
故答案为:ns2np3;M;9;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型为四面体形,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,氨气分子中只含一个孤电子对、水分子中含有两个孤电子对,所以键角,
故答案为:四面体形;>;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为2+$\frac{5-1-2×2}{2}$=2,根据价层电子对互斥理论判断原子杂化方式为sp,
故答案为:sp杂化;
(4)①NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,
故答案为:NH3分子间存在较强的氢键,而NF3分子间仅有较弱的范德华力;
②F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示 ,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个B原子连接4个P原子,则硼原子的配位数为4;已知磷化硼的晶胞边长a=478pm,则晶胞的体对角线长为$\sqrt{3}$a,晶体中硼原子和磷原子的核间距应为体对角线的$\frac{1}{4}$,所以dB-P=$\frac{1}{4}$$\sqrt{3}$×478pm=207pm,
,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个B原子连接4个P原子,则硼原子的配位数为4;已知磷化硼的晶胞边长a=478pm,则晶胞的体对角线长为$\sqrt{3}$a,晶体中硼原子和磷原子的核间距应为体对角线的$\frac{1}{4}$,所以dB-P=$\frac{1}{4}$$\sqrt{3}$×478pm=207pm,
故答案为:4;207.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、氢键、键角、微粒空间构型、原子核外电子排布等知识点,侧重考查学生知识应用、计算、空间想象能力,难点是晶胞计算,注意该晶胞中B-P原子核间距,题目难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质稳定,常温下不与任何物质反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅元素在地壳中的含量居第一位 | |
| C. | 硅在自然界中可以以游离态存在 | |
| D. | 高纯度的单质硅被广泛用于制作计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol/(L•s) | B. | 2mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 0.5mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一原子中,2p、3p、4p能级的轨道数依次增多 | |
| B. | 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则 | |
| C. |  表示的原子能量处于最低状态 表示的原子能量处于最低状态 | |
| D. | 正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 其一种同位素,可被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25,中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
| 化合物 | X3Y4 | R2T2 |
| 晶体类型 | ||
| 熔点/℃ | >3600 | -76 |
 ,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com