
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是
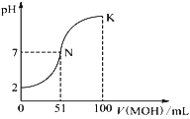
A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】I.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素位于元素周期表第_______周期______族。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为____________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:________
□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
(3)工业制备PH3的流程如图所示。

①黄磷和烧碱溶液反应的化学方程式为_________,次磷酸的化学式为____________,次磷酸属于___________(填“一”“二”或“三”)元酸。
②若起始时有1molP4参加反应,则整个工业流程中共生成 ______ mol PH3.(不考虑产物的损失)
II.某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。

①a表示__________离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品。其中C为硫酸,则A表示_____________。E表示___________________。
②阳极的电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
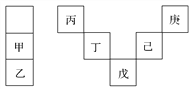
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理元素化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H=+133.6 kJ·mol-1。该反应的化学平衡常数的表达式K=_________。
2NH3(g)+CO2(g) △H=+133.6 kJ·mol-1。该反应的化学平衡常数的表达式K=_________。
关于该反应的下列说法正确的是________(填序号)。
A.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
B.在平衡体系中增加水的用量可使该反应的平衡常数增大
C.当容器中NH3的体积分数不再改变时,反应处于平衡状态
②尿素在一定条件下可将氮的氧化物还原为氮气。

根据图像,结合①中信息,尿素还原NO(g)的热化学方程式是_________。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)![]() CO(NH2)2+H2O(g),混合气体中NH3 的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率V正(CO2)_____b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是_______。
CO(NH2)2+H2O(g),混合气体中NH3 的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率V正(CO2)_____b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是_______。
(2)在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应: 2CO(g)+SO2(g) ![]() S(g)+2CO2(g) △>0, 测得相关数据如下表所示。
S(g)+2CO2(g) △>0, 测得相关数据如下表所示。

下列说法不正确的是________
A.反应开始时的速率:丙>乙 B. b=1.6 C.平衡常数:甲>乙
(3)ClO2是一种安全稳定的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2原理如下:

①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为______。
②电解池中总反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的说法不正确的是
A. 高纯硅具有良好的半导体性能,可制成硅芯片、光电池、光导纤维等
B. 二氧化硅能与氢氟酸反应,可用氢氟酸刻蚀玻璃
C. 向硅酸钠溶液中滴加稀盐酸有不溶物生成,实验室可用该方法制备硅酸
D. “硅胶”由硅酸凝胶经干燥、脱水制得,常用作食品、药品等的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分〕某化学兴趣小组欲探究含硫物质的性质及制备。
【探究一】用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
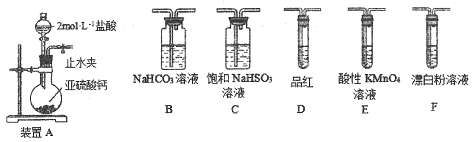
装置连接顺序为_________(用字母表示),其中装置C的作用是___________。
【探究二】
(1)某小组同学为探究SO2的漂白性性质,用下图所示装置进行实验,
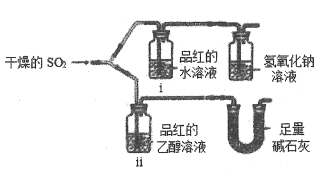
观察到如下现象:i中红色褪去;ii中无变化.碱石灰的作用除了吸收尾气外还有_______的作用。从实验中可知使品红的水溶液褪色的微粒可能是____________。
(2)该小组同学又对SO2与氯水的反应进行探究。
①用注射器吸入一定量的饱和氯水和SO2,振荡,静置,再吸入少量品红溶液,发现品红溶液不褪色。②改变氯水用量,重复①操作,发现品红溶液红色褪去,你认为②中品红溶液褪色的原因可能是__________。 设计一个实验(说明操作方法、现象及结论)来验证你的假设________。
【探究三】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制取Na2S2O4常用甲酸钠法。控制温度70-80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液酸性,即可生成Na2S2O4,反应的离子方捏式________。
(2)测定保险粉纯度。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.10mol·L-1的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL.则该样品中Na2S2O4的质量分数为______ (杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究溶液导电性与离子浓度的关系,某课题小组设计了如下实验:
取一定质量Ba(OH)2溶液做导电性实验,往烧杯中滴加稀硫酸、装置如图1.测得溶液导电强度如图2所示。
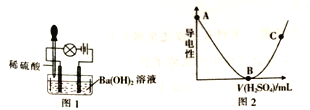
(1)根据组成分类、将盐分为正盐(如Na2CO3)、酸式盐(如NaHCO3)、碱式盐[如碱式碳酸铜Cu2(OH)2CO3等]。NaHSO4属于___________(填字母)。
A.钠盐 B.含氧酸 C.酸式盐 D.氧化物
(2)往烧杯中滴加稀硫酸的过程中,观察到灯泡变化:亮→暗→熄→亮,还可观察到的现象有_________。
(3)图2中,AB段变化的原因是__________;BC段变化的原因是_________。
(4)写出A→B过程中发生反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com