


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
A、KOH(aq)+
| ||||
| B、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ?mol-1 | ||||
| C、H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ?mol-1 | ||||
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、NO3-、Br- |
| B、K+、Na+、SO32-、S2- |
| C、K+、Na+、AlO2-、SO42- |
| D、NH4+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LN2含有分子数为NA |
| B、物质的量浓度为22.4 mol/L MgCl2溶液,含有Cl-数为NA |
| C、标准状况下,22.4 LH2O的分子数为NA |
| D、64g SO2含有氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
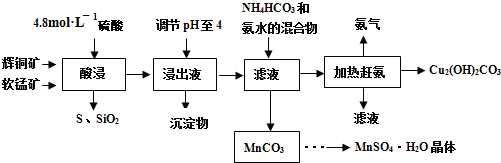
查看答案和解析>>
科目:高中化学 来源: 题型:
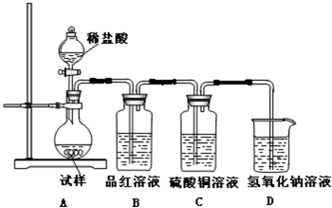
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 装置 | 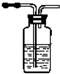 | 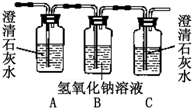 | 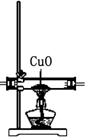 | 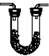 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
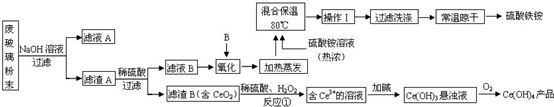

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com