
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.请回答下列问题: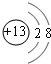 ,故答案为:
,故答案为: ;
;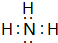 ,故答案为:
,故答案为: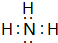 ;
;
| ||
| ||


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
 进入冬季,郑州市频现雾霾天气,给人们的出行和生活带来极大的不便和危害,人们“谈霾色变”.目前郑州市汽车占有量达230万辆,汽车尾气污染是引起雾霾的主要因素之一.
进入冬季,郑州市频现雾霾天气,给人们的出行和生活带来极大的不便和危害,人们“谈霾色变”.目前郑州市汽车占有量达230万辆,汽车尾气污染是引起雾霾的主要因素之一.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 若要在铜片上镀银时,下列叙述中错误的是( )
若要在铜片上镀银时,下列叙述中错误的是( )| A、①③⑥ | B、②③⑥ |
| C、①④⑤ | D、②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、HSO3-、I-(氯气) |
| B、Ca2+、NO3-、Na+、Cl-(二氧化硫) |
| C、Fe3+、SO42-、CO32-、NO3-(氨气) |
| D、Na+、K+、HCO3-、Cl-(二氧化碳) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若P>K,则其氢化物的稳定性HKW<HPZ |
| B、若m>n,则碱性 X(OH)m>Y(OH)n |
| C、若半径aXm+>bY n+,则a<b |
| D、若半径aXm+>bY n+,则X的单质一定能从含Yn+的盐溶液中置换出Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴加BaCl2溶液,出现白色沉淀,再加足量稀HCl,若白色沉淀不溶解,则说明原溶液中一定含SO42- |
| B、某气体通入澄清石灰水溶液能使其变浑浊,该气体一定是CO2 |
| C、向某盐溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则原溶液含NH4+ |
| D、某气体通入滴有紫色石蕊试剂的水中,若水变为红色,该气体一定是SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com