
【题目】在沥青中存在一系列稠环芳烃,按如下特点排列
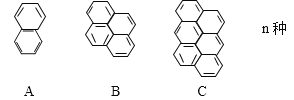
(1)该系列化合物的通式为____________,第25个分子的分子式为_________。
(2)该系列化合物中,碳的质量分数最小值为(填数值)_______,最大值为_________。
【答案】C6n+4H2n+6(n≥1)或C6n+10H2n+8(n≥0) C154H56 93.75% 97.3%
【解析】
根据A、B、C的分子式归纳总结出通式,再根据公式计算碳的质量分数。
(1)A的分子式为C10H8,B的分子式为C16H10,C的分子式为C22H12,因此该系列化合物的通式为C6n+4H2n+6(n≥1)或C6n+10H2n+8(n≥0),第25个分子的分子式为C154H56;故答案为:C6n+4H2n+6(n≥1)或C6n+10H2n+8(n≥0);C154H56。
(2)该系列化合物中,C10H8的碳的质量分数最小为![]() ,最大值为
,最大值为![]() ;故答案为:93.75%;97.3%。
;故答案为:93.75%;97.3%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①容器内气体的压强 ②混合气体的密度
③混合气体的总物质的量 ④B的物质的量浓度
A.②④B.②③C.②③④D.只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A.d为石墨,电流从d流入导线进入铁片
B.d为铜片,铜片上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为镁片,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物合成中间体F制备路线如下:
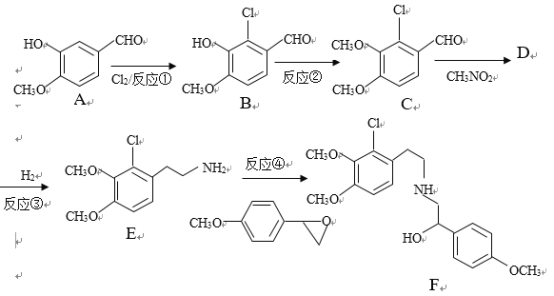
已知:RCHO+R’CH2NO2![]()
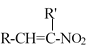 +H2O
+H2O
(1)有机物A结构中含氧官能团的名称是__________________.
(2)反应②中除B外,还需要的反应物和反应条件是___________________
(3)有机物D的结构简式为_____________________,反应③中1摩尔D需要___摩尔H2才能转化为E
(4)反应④的反应物![]() 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
a.结构中含4种化学环境不同的氢原子
b.能发生银镜反应
c.能和氢氧化钠溶液反应
(5)已知:苯环上的羧基为间位定位基,如![]()
![]()
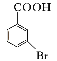 。写出以
。写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)_____________。
的合成路线流程图(无机试剂任选)_____________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两份混合气体,A是烯烃R与足量O2的混合气体;B是烯烃R、炔烃Q与足量O2的混合气体。取A、B各2.24L分别引燃,A充分燃烧后气体总体积仍为2.24L,B充分燃烧后气体总体积为2.34L(燃烧后的产物均为气态,其体积已换算成标准状况)。通过计算,写出:
(1)烯烃R的分子式____________________。
(2)炔烃Q的分子式____________________。
(3)求2.24L B中烯烃R所允许的最大体积是_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀―现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
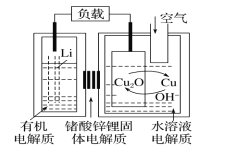
A.放电时,Li+透过固体电解质向右移动
B.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空
(1)氮原子的电子排布式为_________,Z元素在元素周期表中的位置为______
(2)上表中原子半径最大的元素是(写元素符号) _____________,该原子的核外电子占有_____________个轨道,有___________种运动状态。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是______________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1moY单质比1mol硫单质得电子多
c.Y和硫两元素单最低价氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出:X的电子式为______________该反应的热化学方程式__________________
(5)简述碳的同位素中一种原子的用途___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com