
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空
(1)氮原子的电子排布式为_________,Z元素在元素周期表中的位置为______
(2)上表中原子半径最大的元素是(写元素符号) _____________,该原子的核外电子占有_____________个轨道,有___________种运动状态。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是______________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1moY单质比1mol硫单质得电子多
c.Y和硫两元素单最低价氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出:X的电子式为______________该反应的热化学方程式__________________
(5)简述碳的同位素中一种原子的用途___________
【答案】1s22s22p3 第三周期ⅦA族 Si 8 14 ac ![]() Si(s) + 2Cl2(g) = SiCl4(l) + 687kJ 14C用于考古年代测定
Si(s) + 2Cl2(g) = SiCl4(l) + 687kJ 14C用于考古年代测定
【解析】
根据各元素在元素周期表中的位置,可知Y为O元素,X为Si元素,Z为Cl元素。
(1)氮原子为7号元素,原子核外有7个电子,则核外电子排布式为1s22s22p3;Cl元素位于第三周期ⅦA族;
(2)同一周期从左向右,原子半径逐渐减小,同一主族从上到下,原子半径逐渐增大,则原子半径最大的为Si,核外电子排布为1s22s22p63s23p2,占有8个轨道,有14种运动状态;
(3)a.Y单质与H2S溶液反应,溶液变浑浊,说明氧气的氧化性比硫强,则说明Y元素的非金属性比S元素的非金属性强,故a正确;
b.在氧化还原反应中,氧化性强弱与得失电子数没有必然关系,故b错误;
c.元素的非金属性越强,氢化物的稳定性越强,Y和S两元素的简单氢化物受热分解,前者的分解温度高,说明Y的非金属性较强,故c正确;
(4)X为Si其电子式为![]() ;Z为Cl元素,Si和氯气反应可生成SiCl4,根据题目信息可知SiCl4在室温时为液态,则生成1mol液态SiCl4放出的热量为687kJ,所以该反应的热化学方程式为:Si(s) + 2Cl2(g) = SiCl4(l) + 687kJ或Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol;
;Z为Cl元素,Si和氯气反应可生成SiCl4,根据题目信息可知SiCl4在室温时为液态,则生成1mol液态SiCl4放出的热量为687kJ,所以该反应的热化学方程式为:Si(s) + 2Cl2(g) = SiCl4(l) + 687kJ或Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol;
(5)14C用于考古年代测定。


科目:高中化学 来源: 题型:
【题目】在沥青中存在一系列稠环芳烃,按如下特点排列
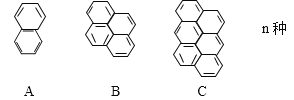
(1)该系列化合物的通式为____________,第25个分子的分子式为_________。
(2)该系列化合物中,碳的质量分数最小值为(填数值)_______,最大值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年诺贝尔化学奖的获得者由于“设计和合成分子机器”而获奖,下列有关分子的描述正确的是( )
A.白磷分子呈正四面体,键角60°,1mol白磷含共价键6mol
B.臭氧分子呈直线型,等质量的臭氧和氧气所含的氧原子数相同
C.S8是分子晶体,8个硫原子在同一个平面上,摩尔质量为256g
D.冰熔化时水分子中共价键发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Q1= 102 kJ·mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△Q2= 422 kJ·mol-1
写出在溶液中NaClO分解生成NaClO3的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中充入lmolO2和2molSO2,在一定条件下发生下列反应2SO2(g)+O2(g)2SO3(g)+Q,5min后测得O2减少了0.1mol。下列说法正确的是( )
A.此反应的平均速率v=0.01mol/(L·min)
B.升高温度,正反应增加的速率一定小于逆反应增加的速率
C.如果不断的加入SO2,最终O2会全部反应完
D.其他条件不变,密闭容器体积改为1L,5min后测得O2减少的量一定大于0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业。“三酸”是指硝、硫酸和盐酸, “两碱”指烧碱和纯碱。回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:________
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列_____
(3)氯的非金属性比硫______(填“强”或“弱”),请用两个事实说明你的结论_______
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①_____________________
②Na2CO3;
③_____________________
④NaHCO3。
若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是___g
(5)将Na2CO3溶于水得到下列数据:
水 | Na2CO3 | 混合前温度 | 混合后温度 |
35ml | 3.2g | 20 | 24.3 |
Na2CO3溶于水______(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释_________
(6) Na2CO3溶液显碱性的原因是(写离子方程式) ___________ ,写出该溶液中的电荷守恒表达式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1 mol的H2O完全反应会生成2 mol的HCl,则X的组成元素是______________;已知X的相对分子质量为153.5,则X的化学式为________________。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07 g X与448 mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2____mol,气体的体积将变为_____mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.48 g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.55 g,计算产物中PCl3的质量分数____________(保留3小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是一种重要的化工原料,其工业生产过程如下:
2FeTiO3(s) + 7Cl2(g) + 6C (s)![]() 2TiCl4(g)+ 2FeCl3(g) + 6CO(g) – Q (Q>0)
2TiCl4(g)+ 2FeCl3(g) + 6CO(g) – Q (Q>0)
回答下列问题:
1.该反应达到平衡后,若使正反应速率增大可采取的方法有_________。(选填编号)
a.加压 b.加入碳 c.升温 d.及时移走CO
2.若上述反应在固定体积的密闭容器中发生,一定能说明反应已达平衡的是_______。(选填编号)
a. 反应物不再转化为生成物
b. 炉内FeTiO3与TiCl4的质量比保持不变
c. 反应的热效应不再改变
d. 单位时间内,n(FeTiO3)消耗:n(FeCl3)生成=1:1
3.上述反应中所有非金属元素原子的半径从大到小的顺序为_____________;其中不属于同周期又不属于相邻族的两元素形成_____分子(填“极性”或“非极性”),通过比较____________可以判断这两种元素的非金属性。
4.上述反应中,非金属性最弱的元素原子的电子共占据_______个原子轨道,最外层电子排布式为____________。它形成的固态单质中只含一种强烈的相互作用力,则该单质属于______晶体。
5.为方便获得氯气,工业制TiCl4厂可以和氯碱厂进行联合生产。CO可合成甲醇,若不考虑损失,上述联合生产在充分利用各种副产品的前提下,合成192 kg甲醇,至少需补充H2_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com