
【题目】今年诺贝尔化学奖的获得者由于“设计和合成分子机器”而获奖,下列有关分子的描述正确的是( )
A.白磷分子呈正四面体,键角60°,1mol白磷含共价键6mol
B.臭氧分子呈直线型,等质量的臭氧和氧气所含的氧原子数相同
C.S8是分子晶体,8个硫原子在同一个平面上,摩尔质量为256g
D.冰熔化时水分子中共价键发生断裂
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①容器内气体的压强 ②混合气体的密度
③混合气体的总物质的量 ④B的物质的量浓度
A.②④B.②③C.②③④D.只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两份混合气体,A是烯烃R与足量O2的混合气体;B是烯烃R、炔烃Q与足量O2的混合气体。取A、B各2.24L分别引燃,A充分燃烧后气体总体积仍为2.24L,B充分燃烧后气体总体积为2.34L(燃烧后的产物均为气态,其体积已换算成标准状况)。通过计算,写出:
(1)烯烃R的分子式____________________。
(2)炔烃Q的分子式____________________。
(3)求2.24L B中烯烃R所允许的最大体积是_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀―现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
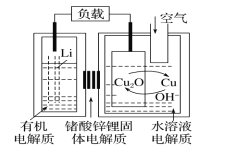
A.放电时,Li+透过固体电解质向右移动
B.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用使锂的需求量大增,自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。
(1)i.为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈_______,可以认为存在锂元素。
A.紫红色 B.绿色 C.黄色 D. 紫色(需透过蓝色钴玻璃)
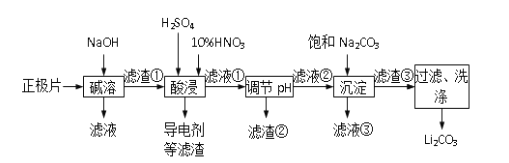
ii锂离子电池的广泛应用同样也要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
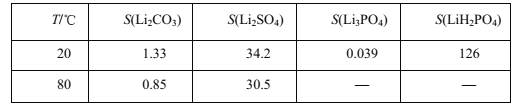
查阅资料,部分物质的溶解度(s),单位g,如下表所示:
(2)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析你认为合理的是___ 。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(3)工业上为了最终获得一种常用金属,向碱溶一步所得滤液中加入一定量硫酸,请写出此时硫酸 参与反应的所有离子方程式 ____________
(4)有人提出在―酸浸时,用H2O2代替HNO3效果会更好。请写出用双氧水代替硝酸时主要反应的化学方程式__________________
(5)若滤液②中c(Li+)=4mol/L加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的95.5%, 计算滤液③中c(CO32-)___________。(Ksp(LiCO)=1.62×10-3)
(6)综合考虑,最后流程中对―滤渣③‖洗涤时,常选用下列________(填字母)洗涤。
A.热水 B.冷水 C.酒精
原因是_______________________
(7)工业上将回收的Li2CO3和滤渣②中FePO4粉碎与足量炭黑混合高温灼烧再生制备 LiFePO4,实现了物质的循环利用,更好的节省了资源,保护了环境。请写出反应的化学方程式:___________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
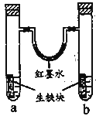
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:![]()
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空
(1)氮原子的电子排布式为_________,Z元素在元素周期表中的位置为______
(2)上表中原子半径最大的元素是(写元素符号) _____________,该原子的核外电子占有_____________个轨道,有___________种运动状态。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是______________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1moY单质比1mol硫单质得电子多
c.Y和硫两元素单最低价氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出:X的电子式为______________该反应的热化学方程式__________________
(5)简述碳的同位素中一种原子的用途___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com