
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用使锂的需求量大增,自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。
(1)i.为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈_______,可以认为存在锂元素。
A.紫红色 B.绿色 C.黄色 D. 紫色(需透过蓝色钴玻璃)
ii锂离子电池的广泛应用同样也要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
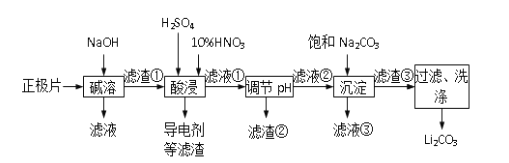
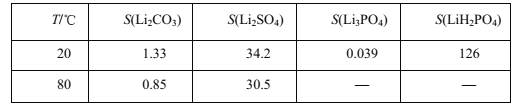
查阅资料,部分物质的溶解度(s),单位g,如下表所示:
(2)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析你认为合理的是___ 。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(3)工业上为了最终获得一种常用金属,向碱溶一步所得滤液中加入一定量硫酸,请写出此时硫酸 参与反应的所有离子方程式 ____________
(4)有人提出在―酸浸时,用H2O2代替HNO3效果会更好。请写出用双氧水代替硝酸时主要反应的化学方程式__________________
(5)若滤液②中c(Li+)=4mol/L加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的95.5%, 计算滤液③中c(CO32-)___________。(Ksp(LiCO)=1.62×10-3)
(6)综合考虑,最后流程中对―滤渣③‖洗涤时,常选用下列________(填字母)洗涤。
A.热水 B.冷水 C.酒精
原因是_______________________
(7)工业上将回收的Li2CO3和滤渣②中FePO4粉碎与足量炭黑混合高温灼烧再生制备 LiFePO4,实现了物质的循环利用,更好的节省了资源,保护了环境。请写出反应的化学方程式:___________________________ 。
【答案】A AC H++ OH-=H2O、H++AlO2-+H2O=Al(OH)3↓ 2LiFePO4 +H2O2+4H2SO4=Li2SO4+Fe2(SO4)3+2 H2O+2H3PO4 0.2mol/L A 碳酸锂的溶解度随温度的升高而减小,用热水洗涤会减少沉淀的溶解,同时热水成本比酒精低 Li2CO3+ 2FePO4+2C= 2LiFePO4+3CO
【解析】
废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)放电拆解后加入氢氧化钠溶液碱浸,过滤得到滤液中偏铝酸钠溶液,滤渣酸浸过滤得到炭黑和硫酸锂、硫酸亚铁的溶液,加入硫酸、硝酸氧化亚铁滤渣生成铁离子,调节溶液pH生成磷酸铁沉淀,过滤后的滤液中加入碳酸钠沉淀锂离子生成碳酸锂,经过滤、洗涤、干燥等操作得到碳酸锂,以此解答该题。
(1)根据锂的焰色反应回答;
(2)将回收的废旧锂离子电池进行预放电,
A.从锂的性质分析;
B.放电是原电池,从离子的移动方向考虑;
C.从有机物与碳的性质分析;
(3)碱溶一步所得滤液中含有偏铝酸钠和氢氧化钠,加入硫酸,首先发生的是酸碱中和,然后是偏铝酸根与氢离子的反应;
(4)LiFePO4在硫酸和过氧化氢同时存在的条件下生成Li2SO4,Fe2(SO4)3,2 H2O和2H3PO4,从环保和价格的角度分析;
(5)利用溶度积进行计算;
(6)碳酸锂的溶解度随温度的变化分析;
(7)根据题目所给信息写出化学方程式;
(1)根据焰色反应原理,锂矿石含有锂元素,锂的焰色反应为紫红色;
(2)A.废旧锂离子电池在处理之前需要进行彻底放电,由于锂是很活泼的金属,容易和氧气,水蒸气发生反应,可能会造成安全隐患,故A正确;
B.放电时,阳离子移向正极,故放电时电池中的锂离子移向正极,故B错误;
C.难溶有机物的沸点一般较低,碳粉也可以被氧化,通过热处理可以除去有机物和碳粉,故C正确;
(3)向碱溶一步所得滤液中加入一定量硫酸,先发生酸碱中和,向偏铝酸钠溶液中加入酸,由于要得到金属,酸的量必须控制,故离子反应为:H++ OH-=H2O,H++AlO2-+H2O=Al(OH)3↓;
(4)H2O2和HNO3都具有强氧化性,由于硝酸见光分解,成本较高,故可以利用过氧化氢代替硝酸,过氧化氢被还原的产物是水,对环境没有污染,化学方程式为2LiFePO4 +H2O2+4H2SO4=Li2SO4+Fe2(SO4)3+2H2O+2H3PO4;
(5)碳酸锂是沉淀,存在难溶电解质的溶解平衡,设两溶液体积为V,滤液②中c(Li+)=4mol/L,沉淀中的Li元素占原Li元素总量的95.5%,则沉淀后溶液中锂离子的浓度为![]() =0.09mol/L,故Ksp (Li2CO3)=c(Li+)2c(CO32-),故c(CO3)=
=0.09mol/L,故Ksp (Li2CO3)=c(Li+)2c(CO32-),故c(CO3)=  =
=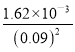 =0.2mol/L;
=0.2mol/L;
(6)碳酸锂的溶解度随温度的升高而减小,用热水洗涤会减少沉淀的溶解,同时热水成本比酒精低;
(7)工业上将回收的Li2CO3和滤渣②中FePO4粉碎与足量炭黑混合高温灼烧再生制备 LiFePO4,反应方程式为Li2CO3+ 2FePO4+2C= 2LiFePO4+3CO。


科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
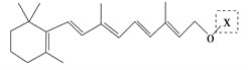
为了研究X的结构,将化合物A在一定条件下水解只得到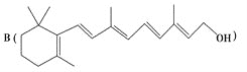 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.氨水应密闭保存,置低温处
B.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C.黄绿色的氯水光照后颜色变浅
D.常温下,用水稀释烧碱溶液pH会降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃是由碳元素和氢元素组成的一类有机物,通常把烷烃泛称“某烷”,“某”是指烷烃中碳原子的数目.碳原子数在十以内的烷烃,依次用“天干”(甲乙丙丁戊己庚辛壬癸)来代表其碳原子数.部分有机物分子组成和结构的表示方法如下:
名称 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
化学式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
结构式 |
|
|
|
|
|
据此推测己烷的化学式为( )
A.C6H12B.C6H24C.C6H18D.C6H14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年诺贝尔化学奖的获得者由于“设计和合成分子机器”而获奖,下列有关分子的描述正确的是( )
A.白磷分子呈正四面体,键角60°,1mol白磷含共价键6mol
B.臭氧分子呈直线型,等质量的臭氧和氧气所含的氧原子数相同
C.S8是分子晶体,8个硫原子在同一个平面上,摩尔质量为256g
D.冰熔化时水分子中共价键发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的结构简式是CH3CH2CH(CH2CH3)CH3,它的正确命名是
A. 2-乙基丁烷 B. 3-乙基丁烷
C. 3-甲基戊烷 D. 2,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中充入lmolO2和2molSO2,在一定条件下发生下列反应2SO2(g)+O2(g)2SO3(g)+Q,5min后测得O2减少了0.1mol。下列说法正确的是( )
A.此反应的平均速率v=0.01mol/(L·min)
B.升高温度,正反应增加的速率一定小于逆反应增加的速率
C.如果不断的加入SO2,最终O2会全部反应完
D.其他条件不变,密闭容器体积改为1L,5min后测得O2减少的量一定大于0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大。其中A为d元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物,常温下乙为液体。下列说法正确的是
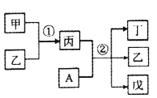
A.简单离子半径:c >b
B.反应①为吸热反应
C.②在常温下反应时,氧化剂与还原剂物质的量之比为1:1
D.b、d分别与a形成的化合物中,化学键类型一定完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com