
����Ŀ���-ͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ��ͨ��һ�ָ��ӵ�ͭ��ʴ�D����������ܣ����зŵ����Ϊ2Li+Cu2O+H2O=2Cu+2Li++2OH-������˵���������( )
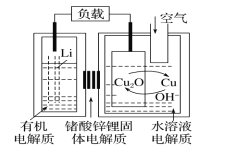
A.�ŵ�ʱ��Li�����������������ƶ�
B.�ŵ�ʱ�������ĵ缫��ӦʽΪO2+2H2O+4e-=4OH-
C.ͨ����ʱ��ͭ����ʴ���������Cu2O
D.������Ӧ�����У�������ΪO2
���𰸡�B
��������
A������ͼʾ����ط�Ӧ��Cu2OΪ������LiΪ�������ŵ�ʱ���������������ƶ�����Li��������������Cu2O���ƶ�����A��ȷ��
B�����ݵ�ط�Ӧʽ֪��������ӦʽΪCu2O+H2O+2e-=Cu+2OH-����B����
C���ŵ����Ϊ2Li+Cu2O+H2O=2Cu+2Li++2OH-����֪ͨ����ʱ��ͭ����ʴ���������Cu2O����C��ȷ��
D��ͨ����ʱ��ͭ����ʴ���������Cu2O���ŵ�ʱCu2Oת��ΪCu����������Ӧ�����У�ͭ�൱�ڴ�����������ΪO2����D��ȷ��
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���������̿�(��Ҫ�ɷ�ΪMnO2��������������������ͭ�����Ƚ���������)���������ͨ�����¼����̼��ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2(��Ӧ������ʡ��)������˵������ȷ����
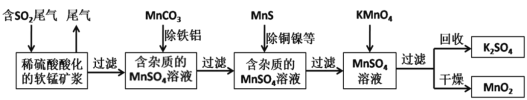
A.���������ж���漰�����˲�����ʵ���ҽ��й��˲���ʱ���õ��Ĺ����β��������У����������ձ���©��
B.��MnCO3�ܳ�ȥ��Һ�е�Al3+��Fe3+����ԭ����MnCO3��������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�����������������
C.ʵ������һ������NaOH��Һ�ͷ�̪��Һ�Ϳ���ȷ�ⶨȼúβ���е�SO2����
D.MnSO4��Һ��MnO2�����У�Ӧ������ҺpH����̫С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������д���һϵ�г����������������ص�����
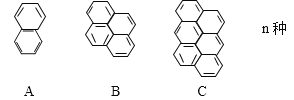
(1)��ϵ�л������ͨʽΪ____________����25�����ӵķ���ʽΪ_________��
(2)��ϵ�л������У�̼������������СֵΪ������ֵ��_______�����ֵΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ���(H2NCH2CH2NH2)�Ƕ�Ԫ�����ˮ�еĵ���ԭ�������ڰ��������£����Ҷ�����Һ�еμ�ϡ���ᣬ��Һ��pH������Ũ�ȱ仯��ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
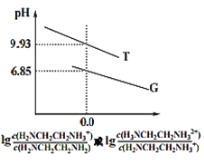
A.Kb2[H2NCH2CH2NH2]��������Ϊ10-8
B.����G����pH��lg![]() �ı仯��ϵ
�ı仯��ϵ
C.H3NCH2CH2NH2Cl��Һ��c(H+)>c(OH-)
D.0.01mol��L-1H2NCH2CH2NH2�����ԼΪ10%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���(����)
A.��ˮӦ�ܱձ��棬�õ��´�
B.��ͭ�ۺ�п�ۻ�Ϻ����ϡ�����У�������������ʱȲ���ͭ�ۿ�
C.����ɫ����ˮ���պ���ɫ��dz
D.�����£���ˮϡ���ռ���ҺpH�ή��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1 mol��L-1 HCN��Һ�еμ�0.1 mol��L-1NaOH����Һ,��ˮ���������������Ũ�������NaOH����ı仯��ͼ��ʾ,������˵����ȷ���� ( )
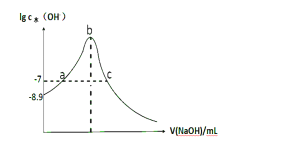
A.������,0.1 mol��L-1HCN�ĵ��볣�� K a������Ϊ10-8
B.a��c������Һ��Ϊ����
C.�� V(NaOH)=10mLʱ��c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D.��V(NaOH)=30mLʱ��2c(OH-)-2c(H+)=c(CN-)+3c(HCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ŵ������ѧ���Ļ�������ڡ���ƺͺϳɷ��ӻ��������������йط��ӵ�������ȷ���ǣ� ��
A.�����ӳ��������壬����60����1mol�������ۼ�6mol
B.�������ӳ�ֱ���ͣ��������ij�����������������ԭ������ͬ
C.S8�Ƿ��Ӿ��壬8����ԭ����ͬһ��ƽ���ϣ�Ħ������Ϊ256g
D.���ۻ�ʱˮ�����й��ۼ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)��Q1= 102 kJ��mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)��Q2= 422 kJ��mol-1
д������Һ��NaClO�ֽ�����NaClO3���Ȼ�ѧ����ʽ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȡ��Ļ�����㷺����ũҩ��ҽҩ��Ⱦ�ϵ�����
(1)PCl3��������ˮ��Ӧ���õ�HCl�����һ����ɫ���д̼��Գ�ζ��Һ��X��ʵ��ⶨ��1 mol��H2O��ȫ��Ӧ������2 mol��HCl����X�����Ԫ����______________����֪X����Է�������Ϊ153.5����X�Ļ�ѧʽΪ________________��
(2)X�ڸ�����O2������Ӧ���γ�P4O10����̬����Cl2����3.07 g X��448 mLO2������������״������ͬ���ڸ����³�ַ�Ӧ������Cl2____mol��������������Ϊ_____mL��
(3)������������ȼ�գ�һ��õ�PCl3��PCl5�Ļ���2.48 g����(P4)����һ����������ǡ����ȫ��Ӧ�������������Ϊ14.55 g�����������PCl3����������____________������3С������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com