
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( ) 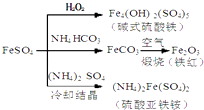
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
【答案】D
【解析】解:A.碱式硫酸铁电离产生Fe3+ , Fe3+ , 能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,故A正确;
B.NH4HCO3不稳定,受热易分解,所以为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,故B正确;
C.KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2若被氧化则生成Fe3+ , KSCN溶液遇Fe3+溶液变红,故C正确;
D.(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,所以FeSO4才能与(NH4)2SO4反应生成(NH4)2Fe(SO4)2 , 故D错误;
故选D.
A.根据Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂;
B.根据NH4HCO3不稳定,受热易分解;
C.KSCN溶液遇Fe2+溶液无现象,遇Fe3+溶液变红;
D.根据溶解度大的沉淀可以转化为溶解度小的沉淀.


科目:高中化学 来源: 题型:
【题目】下列实验中,不能观察到明显的变化的是 ( )
A. 把氯气通入FeCl2溶液中 B. 把一段打磨过的镁带放入少量冷水中
C. 把溴水滴加到KI淀粉溶液中 D. 把绿豆大的钾投入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设:
假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图: 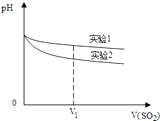
实验1中溶液pH变小的原因是;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
实验步骤 | 实验现象 | 结论 |
实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
实验4: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子分离膜可以让某些物质有选择地通过而将物质分离,下列应用不属于高分子分离膜的应用范围的是( )
A. 分离工业废水,回收废液中的有用成分
B. 食品工业中,浓缩天然果汁,乳制品加工和酿酒
C. 将化学能转换成电能,将热能转换成电能
D. 海水淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA.下列说法正确的是( )
A. 1L0.1molL﹣1NH4Cl溶液中,NH4+的数量为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. H2(g)转化为氢原子是一个放热过程
B. 1molH2和1molCl2的总能量比2molHCl的总能量低
C. 1 个 HCl(g)分子中的化学键断裂时需要吸收431.8 kJ能量
D. 2HCl(g)= H2(g)+Cl2(g)的反应热ΔH=+184.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 同分异构体的化学性质不一定相同 B. 同素异形体的化学性质不一定相同
C. 同位素原子的化学性质不一定相同 D. 同系物的物质物理性质不一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A.2 个 B.3 个 C.4 个 D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入稀氢氧化钠溶液后,将湿润的红色石蕊试纸放在试管口 | 试纸没有变蓝色 | 溶液中不含NH4+ |
B | 溴乙烷与NaOH溶液供热后,加HNO3酸化,再加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
C | Mg(OH)2悬浊液中加入pH=7的醋酸铵溶液 | 沉淀溶解 | 加入醋酸铵发生 NH4++OH- 使Mg(OH)2Mg2++2OH-平衡向右移动 |
D | 洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再加入CuSO4溶液 | 铁钉表面无红色物质生成 | 铁钉在浓硝酸中已钝化 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com