
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________;同一片层划分出的一个二维晶胞(平行四边形)含有_______个H3BO3分子。
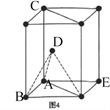
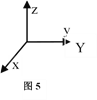
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________
【答案】 ![]() 正四面体形 6
正四面体形 6 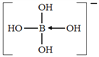 CH4 、NH4+ (BO2)nn- sp3 、 sp2 氢键、共价键、范德华力 2 (2/3,1/3,1/2)
CH4 、NH4+ (BO2)nn- sp3 、 sp2 氢键、共价键、范德华力 2 (2/3,1/3,1/2)
【解析】(1)B是5号元素,基态B原子的价电子为2s22p1,价电子的轨道表达式为![]() ,第二周期第一电离能比B高的元素有Be、C、N、O、F、Ne等6种。
,第二周期第一电离能比B高的元素有Be、C、N、O、F、Ne等6种。
(2)B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的中心原子形成4个σ键,其中有一个是配位键,由O原子提供了孤对电子,其结构式为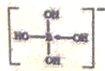 ,其中心原子B原子的价层电子对数为4,故其VSEPR模型为正四面体形, [BH4]-的等电子体有CH4、NH4+等。
,其中心原子B原子的价层电子对数为4,故其VSEPR模型为正四面体形, [BH4]-的等电子体有CH4、NH4+等。
(3)由图1可知,偏硼酸根中每个B形成3个共价键、每个O形成2个共价键,所以平均每个B原子结合2个O原子,由B和O的化合价分别为+3和-2可知,其化学式可表示为![]() ;由图2可知,五硼酸根离子中有2种B原子,一种形成4个共价键,另一种形成3个共价键,故其中B原子的杂化方式为sp3、sp2。
;由图2可知,五硼酸根离子中有2种B原子,一种形成4个共价键,另一种形成3个共价键,故其中B原子的杂化方式为sp3、sp2。
(4)硼酸晶体是片层结构的分子晶体,由图3可知,同一层微粒间存在的作用力有氢键、共价键,范德华力等3种;由均摊法可知,每个晶胞周围可形成4个晶胞、每个晶胞中包含8个硼酸分子,故平均同一片层划分出的一个二维晶胞含有2个H3BO3分子。
(5)若建立如图5所示的坐标系,x与y两轴的夹角为120,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、C的坐标分别为B(1,0,0)、c(0,0,1),由图可知,D点与A、B以及底面右下角等3个点构成一个正四面体,D点位于其顶点,其高度为晶胞高度的一半。由D点向底面作垂线,垂足为中线的三等分点,则垂足的坐标为(![]() ,0),所以D点的坐标为D(
,0),所以D点的坐标为D(![]() )。
)。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】不需要使用其他试剂,仅通过溶液的相互滴加即可鉴别的溶液是( )
A.AlCl3、NaOHB.H2SO4、KOHC.NaCl、KNO3D.MgCl2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将8molX与12molY的混合气体通入一个体釈内2L的密闭容器中,发生如下反应:X(g)+3Y(g)![]() 2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
(1)平衡吋,Y的物貭的量浓度为_______。
(2)10min内,Z的平均反应速率为_______ 。
(3)达到平衡时,容器内起始吋与平衡吋的圧強之比是_______ 。
(4)不能証明该反应达到化学平衡状态的标志是_______ (填字母)
A.圧強不再发生変化 B.混合气体的相对分子貭量不再发生変化
C.X、Y、Z的分子数之比内1:3:2 D.混合气体的密度不変
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
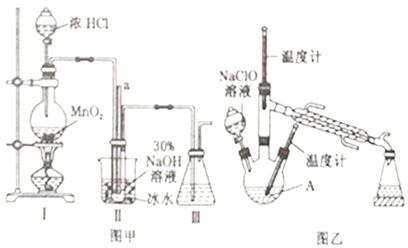
实验1:制备NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为________________________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有_______________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是________________________。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分N2H4·H2O会参与A 中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为__________________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入适量NaHCO3固体,则测量结果会___________“偏大”“ 偏小”“ 无影响”)。
②下列能导致馏分中水合肼的含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CO2分子的结构式为O=C=O
B. 稀士元素![]() 与
与![]() 互为同素异形体
互为同素异形体
C. 核外电子排布相同的微粒,化学性质也相同
D. 某放射性核素![]() 的原子核外电子数为99
的原子核外电子数为99
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式与其他三个不同的是( )
A.澄清石灰水中滴加碳酸钠溶液B.氯化钙溶液中滴加碳酸钾溶液
C.硝酸钙溶液中滴加碳酸铵溶液D.澄清石灰水中通入二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.MgF2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com