
【题目】恒温下,将8molX与12molY的混合气体通入一个体釈内2L的密闭容器中,发生如下反应:X(g)+3Y(g)![]() 2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
(1)平衡吋,Y的物貭的量浓度为_______。
(2)10min内,Z的平均反应速率为_______ 。
(3)达到平衡时,容器内起始吋与平衡吋的圧強之比是_______ 。
(4)不能証明该反应达到化学平衡状态的标志是_______ (填字母)
A.圧強不再发生変化 B.混合气体的相对分子貭量不再发生変化
C.X、Y、Z的分子数之比内1:3:2 D.混合气体的密度不変
【答案】 3mol/L 0.2mol(L·min) 5:4 CD
【解析】本题考查的化学反应的计算和平衡的标志。难度较小。根据化学平衡计算的三段式进行是基本要求。
X(g)+3Y(g)![]() 2Z(g)
2Z(g)
起始物质的量浓度4 6 0
改变物质的量浓度 x 3x 2x
平衡时物质的量浓度4-x 6-3x 2x
根据题中信息分析有关系式 ![]() ,解x=1mol/L (1)根据以上分析,平衡时Y的物质的量浓度为6-1×3=3mol/L;
,解x=1mol/L (1)根据以上分析,平衡时Y的物质的量浓度为6-1×3=3mol/L;
(2) 10min内,Z的平均反应速率2×1/10=0.2mol(L·min);
(3) 达到平衡时,容器内起始时与平衡时的圧強之比等于气体的物质的量和的比,即为![]() ; (4) A.因为该反应前后气体物质的量总和改变,所以压强不变可以说明反应到平衡,故正确;B.该反应中物质全为气体,且前后气体的物质的量改变,所以混合气体的相对分子质量不再发生变化可以说明混合气体的总物质的量不变,说明该反应到平衡故正确;C.X、Y、Z的分子数之比为1:3:2不能说明下一时刻的比例关系,不能确定是平衡状态,故错误;D.因为混合气体总质量不变,容器的体积不变,则混合气体的密度始终不変,所以密度不变不能说明反应到平衡,故错误。故选CD。
; (4) A.因为该反应前后气体物质的量总和改变,所以压强不变可以说明反应到平衡,故正确;B.该反应中物质全为气体,且前后气体的物质的量改变,所以混合气体的相对分子质量不再发生变化可以说明混合气体的总物质的量不变,说明该反应到平衡故正确;C.X、Y、Z的分子数之比为1:3:2不能说明下一时刻的比例关系,不能确定是平衡状态,故错误;D.因为混合气体总质量不变,容器的体积不变,则混合气体的密度始终不変,所以密度不变不能说明反应到平衡,故错误。故选CD。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是
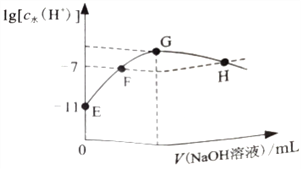
A. 用pH试纸测定E点对应的溶液,其pH=3
B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-)
C. 加水稀释H点对应的溶液,溶液的pH增大
D. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易水解,可用作肥料、灭火剂、洗涤剂等。实验室制备氨基甲酸铵的反应如下:2NH3(g)+CO2(g) ![]() NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
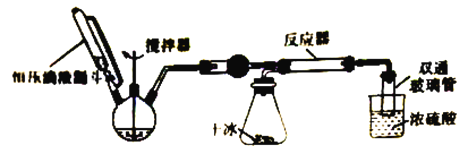
步骤1:按图连接好实验装置,____________________。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
(1)将步骤1补充完整:________________________
(2)干燥管中盛放的药品是___________________________
(3)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有____________________(写出一种即可)。
(4)三颈烧瓶中产生氨气的原理是________________________________。
(5)反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是________________。
(6)尾气处理装置中双通玻璃管的作用是_________________(用文字叙述),浓硫酸的作用是_______________、______________。
(7)取部分变质(混有碳酸氢铵的氨基甲酸铵)样品1.173g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。则样品中氨基甲酸铵的物质的量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂是密度最小的活泼金属,其单质及其化合物如:LiAlH4、Li2CO3、 LiPF6等有广泛的用途。工业上以锂辉石(主要成分为LiAlSi2O6,还含有硫酸钙、硫酸镁和铁的氧化物)为原料,制备Li2CO3的的工艺流程如下:

已知①LiAlSi2O6和H2SO4会生成SiO2
②
Fe3+ | A13+ | Fe2+ | Mg2+ | |
氢氧化物完全沉淀pH | 3.2 | 4.7 | 9.0 | 11.1 |
③某些物质的溶解度(S) 如下表
t/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
请回答下列问题:
(1)LiAlSi2O6改写成氧化物的形式是___________________。
己知表中40℃Li2CO3溶解度(饱和溶液的密度为ag/cm3),则Li2CO3的溶度积(Ksp) 为________,(用含有a的代数式表示)
(2)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子 方程式为____________________。
(3)己知滤渣2 的主要成分有Mg(OH)2 。向滤液a中加入石灰乳的作用是(运用化学平衡原理简述)___________________。用热水洗涤Li2CO3固体目的是___________________。
Ⅱ.锂单质制备及其化合物的性质
1)用碳酸锂和盐酸反应得到氯化锂溶液,写出如何从氯化锂溶液得到无水氯化锂固体的实验方法__________________。
(2) 已知2Li+H2![]() 2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1 | 图2 | 图3 |
|
|
|
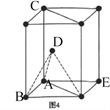
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________;同一片层划分出的一个二维晶胞(平行四边形)含有_______个H3BO3分子。
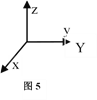
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象不能实验预期的目的是( )
A.用食醋,石灰水来验证蛋壳的成分是碳酸盐
B.用银氨溶液鉴别乙醇和乙醛
C.用酸性高锰酸钾验证苯中是否含有碳碳双键
D.用溴水鉴别乙烯和乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是(ΔH<0表示放热)( )
A.N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.N2(g)+O2(g) ![]() 2NO(g) ΔH<0
2NO(g) ΔH<0
C.2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
D.C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ΔH>0
CO2(g)+2H2(g) ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com