
【题目】下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是(ΔH<0表示放热)( )
A.N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.N2(g)+O2(g) ![]() 2NO(g) ΔH<0
2NO(g) ΔH<0
C.2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
D.C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ΔH>0
CO2(g)+2H2(g) ΔH>0
【答案】D
【解析】升温平衡正向移动,说明正反应吸热,减压平衡正向移动,说明正反应气体分子数增大;
A项,正反应放热,气体分子数减小,故A不符合题意;
B项,正反应放热,气体分子数不变,故B不符合题意;
C项,正反应放热,气体分子数减小,故C不符合题意;
D项,正反应吸热,气体分子数增大,故D符合题意。
所以答案是:D
【考点精析】利用化学平衡状态本质及特征和化学平衡移动原理以及影响因素对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将8molX与12molY的混合气体通入一个体釈内2L的密闭容器中,发生如下反应:X(g)+3Y(g)![]() 2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
(1)平衡吋,Y的物貭的量浓度为_______。
(2)10min内,Z的平均反应速率为_______ 。
(3)达到平衡时,容器内起始吋与平衡吋的圧強之比是_______ 。
(4)不能証明该反应达到化学平衡状态的标志是_______ (填字母)
A.圧強不再发生変化 B.混合气体的相对分子貭量不再发生変化
C.X、Y、Z的分子数之比内1:3:2 D.混合气体的密度不変
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CO2分子的结构式为O=C=O
B. 稀士元素![]() 与
与![]() 互为同素异形体
互为同素异形体
C. 核外电子排布相同的微粒,化学性质也相同
D. 某放射性核素![]() 的原子核外电子数为99
的原子核外电子数为99
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,且HCl既不作氧化剂也不作还原剂的是( )
A.PbO2+4HCl=PbCl2+Cl2↑+2H2OB.NaOH+HCl=NaCl+H2O
C.2FeCl2+H2O2+2HCl=2FeCl3+2H2OD.Zn+2HCl=ZnCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式与其他三个不同的是( )
A.澄清石灰水中滴加碳酸钠溶液B.氯化钙溶液中滴加碳酸钾溶液
C.硝酸钙溶液中滴加碳酸铵溶液D.澄清石灰水中通入二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2O(l)=H2(g)+ ![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+ ![]() O2(g)=H2O(g)ΔH=-241.8 kJ/mol
O2(g)=H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-57.3 kJ/mol
④C(s)+ ![]() O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时(填“吸收”或“放出”)热量,△H0(填“>”或“<”)
(2)上述反应中属于吸热反应的是
(3)C的燃烧热为;H2燃烧生成气态水的热值为 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4-、Na+、Cl-B.K+、Ca2+、NO3-、CO32-
C.Fe3+、Na+、Cl-、SO42-D.Na+、OH-、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
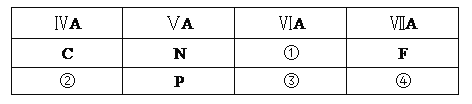
(1)表中③的元素符号是_________;④元素原子的最外层电子数是___________。
(2)氮元素的最低价氢化物的化学式为___________,该氢化物属于____________化合物(填“离子”或“共价”), ②元素的原子结构示意图为___________。
(3)某同学为了比较氯气和硫单质的氧化性强弱,收集到下列三条信息:
①Cl2 + H2S(溶液)= S↓ + 2HCl;
②Cl2比S更容易跟H2反应生成氢化物;
③在加热条件(相同温度)下,铁与氯气反应的产物是氯化铁,而铁与硫反应的产物是硫化亚铁。
根据以上信息可知:氯气的氧化性________________硫单质的氧化性(填“强于”或“弱于”);在加热条件下,铜与足量的氯气反应的产物是________________(填化学式)、铜与足量的硫反应的产物是__________________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com