
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易水解,可用作肥料、灭火剂、洗涤剂等。实验室制备氨基甲酸铵的反应如下:2NH3(g)+CO2(g) ![]() NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
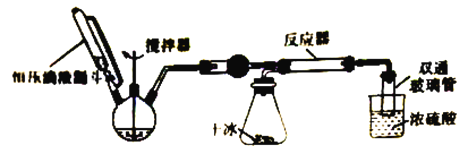
步骤1:按图连接好实验装置,____________________。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
(1)将步骤1补充完整:________________________
(2)干燥管中盛放的药品是___________________________
(3)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有____________________(写出一种即可)。
(4)三颈烧瓶中产生氨气的原理是________________________________。
(5)反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是________________。
(6)尾气处理装置中双通玻璃管的作用是_________________(用文字叙述),浓硫酸的作用是_______________、______________。
(7)取部分变质(混有碳酸氢铵的氨基甲酸铵)样品1.173g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。则样品中氨基甲酸铵的物质的量分数为___________。
【答案】 检查装置的气密性 碱石灰或固体NaOH 不需要干燥 提供低温环境,提高转化率(其他合理答案也可) NaOH固体溶于水产生大量的热,使浓氨水分解产生氨气 调节恒压滴液漏斗的旋塞,减慢浓氨水的滴加速度 防止倒吸 吸收多余的氨气 防止空气中的水蒸气进入反应器使氨基甲酸铵水解 80%
【解析】(1)有气体生成或产生的实验,按图连接好实验装置后必须检查装置的气密性;(2)干燥管中盛放的药品用于干燥氨气可以选用碱石灰或固体NaOH;(3)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有不需要干燥、提供低温环境,提高转化率等;(4)三颈烧瓶中产生氨气的原理是NaOH固体溶于水产生大量的热,使浓氨水分解产生氨气;(5)反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是调节恒压滴液漏斗的旋塞,减慢浓氨水的滴加速度;(6)尾气处理装置中双通玻璃管的作用是防止倒吸,浓硫酸的作用是吸收多余的氨气、防止空气中的水蒸气进入反应器使氨基甲酸铵水解;(7)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g.物质的量为![]() =0.015mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,由碳元素守恒可知,x+y=0.015mol,78x+79y=1.173g,解得x=0.012mol y=0.003mol,则样品中氨基甲酸铵的质量为0.012mol×78g/mol=0.936g,质量分数=
=0.015mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,由碳元素守恒可知,x+y=0.015mol,78x+79y=1.173g,解得x=0.012mol y=0.003mol,则样品中氨基甲酸铵的质量为0.012mol×78g/mol=0.936g,质量分数=![]() ×100%=80.0%。
×100%=80.0%。


科目:高中化学 来源: 题型:
【题目】下列物质分类完全正确的一组是
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 纯净的空气 | 盐酸 | 硫酸 | 硫酸钡 |
B | 胆矾 | 肥皂水 | 氧化铝 | 干冰 |
C | 纯碱 | 玻璃 | 铝 | 蔗糖 |
D | 生石灰 | Fe(OH)3胶体 | 氯化钠 | 氯气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A.该反应正反应为吸热反应
B.达平衡时,甲、乙容器内:2c(CO2 , 甲)<c(CO2 , 乙)
C.达平衡时,容器甲中的逆反应速率比容器乙中的大
D.达平衡时,转化率:a(CO2 , 甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不需要使用其他试剂,仅通过溶液的相互滴加即可鉴别的溶液是( )
A.AlCl3、NaOHB.H2SO4、KOHC.NaCl、KNO3D.MgCl2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,2 L密闭容器内,反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO))/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
该反应达到平衡状态的时间是
A.3 min
B.1 min
C.2 min
D.0 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将8molX与12molY的混合气体通入一个体釈内2L的密闭容器中,发生如下反应:X(g)+3Y(g)![]() 2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
2Z(g),10min后反应达到平衡,其中Z的含量(体积分数)为25%。
(1)平衡吋,Y的物貭的量浓度为_______。
(2)10min内,Z的平均反应速率为_______ 。
(3)达到平衡时,容器内起始吋与平衡吋的圧強之比是_______ 。
(4)不能証明该反应达到化学平衡状态的标志是_______ (填字母)
A.圧強不再发生変化 B.混合气体的相对分子貭量不再发生変化
C.X、Y、Z的分子数之比内1:3:2 D.混合气体的密度不変
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2O(l)=H2(g)+ ![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+ ![]() O2(g)=H2O(g)ΔH=-241.8 kJ/mol
O2(g)=H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-57.3 kJ/mol
④C(s)+ ![]() O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时(填“吸收”或“放出”)热量,△H0(填“>”或“<”)
(2)上述反应中属于吸热反应的是
(3)C的燃烧热为;H2燃烧生成气态水的热值为 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com