
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示. 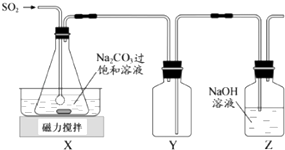
当溶液pH约为4时,停止反应.在20℃左右静置结晶.生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体.用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4 , 其可能的原因是
【答案】
(1)2SO2+CO32﹣+H2O=2HSO3﹣+CO2
(2)防止倒吸
(3)吸滤瓶;减少Na2S2O5在水中的溶解
(4)在制备过程中Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化生成Na2SO4
【解析】解:(1)向Na2CO3过饱和溶液中通入SO2 , 发生反应生成NaHSO3和CO2 , 反应的离子方程式为2SO2+CO32﹣+H2O=2HSO3﹣+CO2 ,
所以答案是:2SO2+CO32﹣+H2O=2HSO3﹣+CO2;(2)二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸,所以答案是:防止倒吸;(3)①组成减压抽滤装置的主要仪器是布氏漏斗、吸滤瓶和抽气泵,所以答案是:吸滤瓶;②由反应2NaHSO3═Na2S2O5+H2O可知,增大HSO3﹣的浓度,有利于生成Na2S2O5 , 用饱和SO2水溶液洗涤,可降低Na2S2O5的溶解度,减少Na2S2O5的溶解,
所以答案是:减少Na2S2O5在水中的溶解;(4)Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化,可知验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 ,
所以答案是:在制备过程中Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化生成Na2SO4 .


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/L NaOH溶液进行滴定,则所需NaOH溶液的体积( )
A.大于20mL
B.小于20mL
C.等于20mL
D.等于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是( )
A.v(A)=9.0mol/(Lmin)
B.v(B)=0.6 mol/(Ls)
C.v(C)=0.3 mol/(Ls)
D.v(D)=0.1 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是
A. HNO3可以制化肥、农药 B. NH3作制冷剂
C. Fe3O4用作红色油漆和涂料 D. Na2O2用作供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:
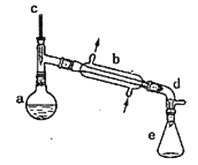
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用实验室制溴苯的废催化剂FeBr3作原料,制取溴的苯溶液和无水FeCl3 . 下列设计能达到相应实验目的是( ) 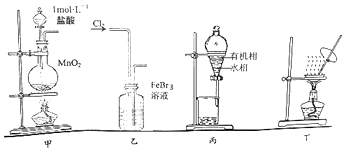
A.用装置甲制取氯气
B.用装置乙氧化FeBr3溶液中的溴离子
C.用装置丙分液时先从下口放出水相,再从上口倒出有机相
D.用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制H2的化学反应是Zn + H2SO4 = ZnSO4 + H2↑。该反应中,氧化剂是_________,被氧化的物质是_________。若反应生成1 mol H2, 则反应中电子转移的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ce是地壳中含量最高的稀土金属元素,下列关于14058Ce的说法正确的是
A. 质子数为82 B. 质量数为198
C. 中子数为140 D. 核外电子数为58
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO2及2PbCO3Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料.
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到.
①Pb(NO3)2被氧化为PbO2的离子方程式为 .
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K=1已知:Ksp(PbS)=3.55×10﹣28;H2S电离常数Ka1=1.3×10﹣7 , Ka2=7.1×10﹣15].
(2)制备碱式碳酸铅的实验步骤如图1: 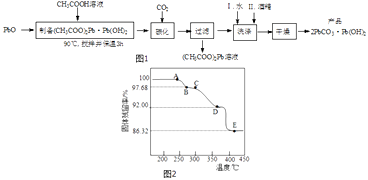
①“碳化”时,发生反应的化学方程式为 .
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 .
(3)为确定2PbCO3Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图2所示.
①A→B过程中,从体系中逸出的分解产物(化合物)为(填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为(填化学式).
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com