
【题目】在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g)![]() 2SO3(g);△H<0,
2SO3(g);△H<0,
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

Ⅰ II III
A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
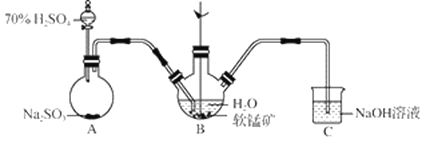
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
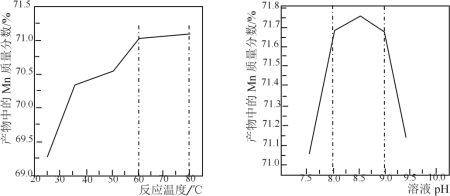
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是( )

A. K与M、N均断开,一段时间后电解质溶液质量变大
B. K分别与M、N相连时,铁均受到保护
C. K与M相连时,每转移1mol电子Fe表面生成32gCu
D. K与N相连时, 碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)。
Y(g)+3Z(g)。
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为________ mol·L-1·min-1。
(2)若向达到(1)的平衡体系中充入氦气,则平衡______(填“向左”、“向右”或“不”)移动;若从达到(1)的平衡体系中移走部分Y气体,则平衡________(填“向左”、“向右”或“不”)移动。
(3)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较________。
A.无法确定 B.前者一定大于后者 C.前者一定等于后者 D.前者一定小于后者
(4)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. KOH中含有离子键也含有共价键,属于离子化合物
B. HCl中存在离子键,属于离子化合物
C. 含有共价键的化合物一定是共价化合物
D. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
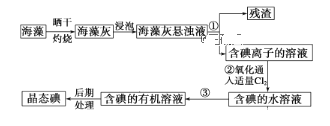
(1)指出提取碘的过程中①的实验操作名称_________及玻璃仪器名称______________________________________。
(2)写出过程②中有关反应的离子方程式:_____________________。
(3)操作③的名称_____________,用到的主要仪器_____________。
(4)提取碘的过程中,可供选择的有机试剂是(______)。
A.酒精 B.四氯化碳 C.甘油 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是某种药物的中间体,其结构简式如图,关于有机物A的说法正确的是
![]()
A. A既可发生氧化反应,又可发生加成反应
B. A可使酸性KMnO4溶液褪色,不可使溴的CCl4溶液褪色
C. A苯环上的一氯代物同分异构体有2种
D. A的分子式为C16H16O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】830K时,在密闭容器中发生下列反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态______(填“是”或“否”),此时v(正)_______v(逆)
(3)若降低温度,H2的体积分数增大,该反应的K值将___________,正反应的速率将__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 常温常压下,30g乙烷气体中所含有的共价键数目为6NA
B. 常温下,100mL0.1mol/L NH4Cl溶液中含有NH4+数目为0.01NA
C. 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2 NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com