
| m |
| M |
| n |
| V |
| m |
| M |
| 20g |
| 40g/mol |
| n |
| V |
| 0.5mol |
| 0.5L |


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| 实验 | 实验现象 | 结论 |
| A | 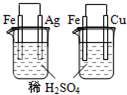 烧杯中银表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Fe>Cu>Ag |
| B |  边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C |  淡黄色固体先变为白色,后变为黑色 | 溶解性:AgCl>AgBr>Ag2S |
| D | 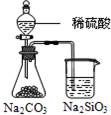 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
| A、A | B、B | C、B | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子 | 立体结构 | 中心原子 氧化数 | 中心原子 杂化轨道类型 |
| SO2Cl2 | |||
| ICl4- |
| 2π | 4 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
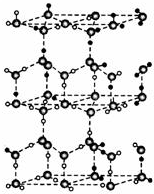 水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.
水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
120 56 |
| A、钡原子的核外电子排布 |
| B、钡元素在周期表中的位置 |
| C、钡原子的核电荷数 |
| D、钡元素的相对原子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com