
| 粒子 | 立体结构 | 中心原子 氧化数 | 中心原子 杂化轨道类型 |
| SO2Cl2 | |||
| ICl4- |
| 2π | 4 3 |
| 1 |
| 2 |
 ;
; ,
, ;
; ;
;| 8-4 |
| 2 |
| 粒子 | 立体结构 | 中心原子 氧化数 | 中心原子 杂化轨道类型 |
| SO2Cl2 | 四面体型 | +6 | sp3 |
| ICl4- | 平面正方形 | +3 | sp3d2 |
| π | 4 3 |
| π | 6 4 |
| π | 4 3 |
| π | 6 4 |


科目:高中化学 来源: 题型:
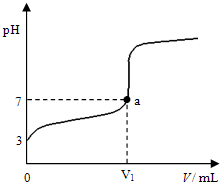 某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )
某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )| A、该温度下醋酸的电离平衡常数约为1×10-5mol?L-1 |
| B、图中V1>20mL,且a点对应的溶液中:c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| C、图中V1<20mL,且a点对应的溶液中:c (CH3COOH)+c (CH3COO-)>c (Na+) |
| D、当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH)+c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| M |
| m(总) |
| n(总) |
. |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(N2):c(H2):c(NH3)=1:3:2 |
| B、一个N≡N 断裂的同时,有3个H-H生成 |
| C、其他条件不变时,混合气体的密度不再改变 |
| D、v正(N2)═2 v逆(NH3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com