
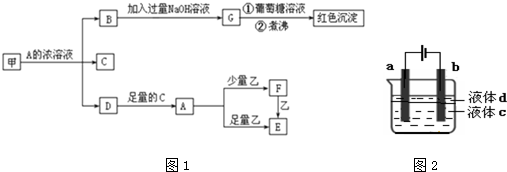
 ;
; ;
;

 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、10mL 0.2 mol?L-1的氨水与10mL 0.1mol?L-1的盐酸充分反应混合后的溶液中,存在:c(NH4+)+c(NH3?H2O)=2c(Cl-)=0.1mol?L-1 |
| B、已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
| C、CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、NaHSO3溶液中一定有:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
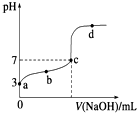 常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)等于10-3mol?L-1 |
| B、b点表示的溶液中c(CH3COO-)>c(Na+) |
| C、c点表示的溶液中c(CH3COO-)=c(Na+) |
| D、d点表示的溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、若离子交换膜为阴离子交换膜,则电解过程中氢氧根向阳极移动 |
| D、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸铜溶液:Cu+2H+
| ||||
| C、在100mL浓度为1mol?L-1的Fe(NO3)3的溶液中通入足量SO2 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | ||||
| D、实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com