
| A、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸铜溶液:Cu+2H+
| ||||
| C、在100mL浓度为1mol?L-1的Fe(NO3)3的溶液中通入足量SO2 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | ||||
| D、实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- |
| ||


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
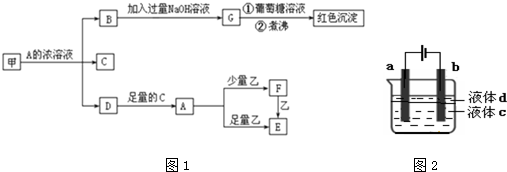
查看答案和解析>>
科目:高中化学 来源: 题型:
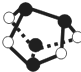 NA表示阿伏加德罗常数的值,下列说法正确的是( )
NA表示阿伏加德罗常数的值,下列说法正确的是( )| A、0.5mol雄黄(As4S4结构如图)含有NA个S-S键 | ||||
| B、7.8g Na2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | ||||
C、1.8g
| ||||
| D、氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置Ⅰ可用于测定中和热 |
| B、装置Ⅱ装置放置一段时间后,饱和CuSO4溶液中不出现蓝色晶体 |
| C、装置Ⅲ中的石英坩埚可用于熔化氢氧化钠 |
| D、装置Ⅳ可用于吸收易溶于水的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1mol M最多可以与2mol Br2发生反应 |
| B、M在一定条件下可以发生消去反应、取代反应和加成反应 |
| C、一个M分子中最多有8个碳原子在同一平面上 |
| D、1mol M与足量的NaOH溶液反应,最多可以消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中c(H+)=
| ||
B、物质的量浓度c(HA)=
| ||
C、t℃时,HA的溶解度S=
| ||
D、HA的质量分数w(HA)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、84g NaHCO3晶体中含有NA个CO32- |
| B、0.1mol?L-1K2CO3溶液中,阴离子总数大于0.1NA |
| C、1.8g石墨和C60的混合物中,碳原子数目为0.15NA |
| D、标准状况下,22.4L CCl4中含有的共用电子对数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com