
| A.在三种酸HX、HY、HZ中以HX酸性相对最强 |
| B.HX、HY、HZ三者均为弱酸 |
| C.在X-、Y-、Z-三者中,以Z-最易发生水解 |
| D.中和1 mol HY酸,需要的NaOH稍小于1 mol |
科目:高中化学 来源:不详 题型:单选题
| A.相同浓度的两溶液中c(OH-) 相同 |
| B.pH=13的两溶液稀释100倍,pH都为11 |
| C.100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 |
| D.两溶液中分别加入少量对应的硫酸盐,c(OH-) 均明显减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入少量0.1 mol·L-1的硫酸,水电离产生的c(H+)减小 |
| B.升高温度,溶液的pH会增大 |
| C.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.把40gNaOH溶解于1L水中即得到1mol/L的的NaOH溶液 |
| B.将4.48LNH3溶解于水配成1L溶液即得到0.2mol/L的氨水溶液 |
| C.配制0.2mol/L的的CuSO4溶液480mL,需硫酸铜晶体的质量为25g |
| D.配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,则配出浓度偏高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
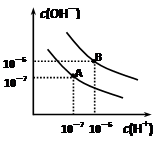
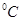 时水的电离平衡曲线应为 (填“A”或“B”)。
时水的电离平衡曲线应为 (填“A”或“B”)。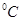 时,将
时,将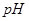 =8的NaOH溶液与
=8的NaOH溶液与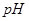 =5的
=5的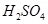 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的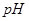 =7,则NaOH溶液与
=7,则NaOH溶液与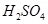 溶液的体积比为 。
溶液的体积比为 。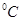 时,0.1 mol/L的NaOH溶液的pH值是 。
时,0.1 mol/L的NaOH溶液的pH值是 。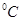 时,若100体积
时,若100体积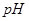 1=
1=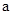 的某强酸溶液与1体积
的某强酸溶液与1体积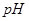 2=b的某强碱溶液混合后溶液呈中性,则混合前,
2=b的某强碱溶液混合后溶液呈中性,则混合前,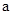 与b之间应满足的关系是
与b之间应满足的关系是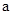 = (用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。
= (用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol/L的Na2SO3溶液中粒子浓度关系:c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) |
| B.将常温下pH=12的氢氧化钠溶液与pH=2的醋酸溶液等体积混合后,溶液呈碱性 |
| C.把等体积的1×10-5 mol/L的硫酸与4×10-5 mol/L的NaOH溶液相混合,混合液的pH值与5×10-6 mol/L的Ba(OH)2溶液的pH值相同 |
| D.0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-) = c(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.偏高 | B.偏低 | C.不受影响 | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸。 |
| B.用某仪器量取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。 |
| C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。 |
| D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com