
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇。反应为![]() 某温度下,在容积为2L的密闭容器中进行该反应,其相关数据如图:
某温度下,在容积为2L的密闭容器中进行该反应,其相关数据如图:
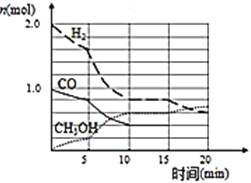
(1)从反应开始至平衡时,用CO表示化学反应速率为 ______ ,该温度下的平衡常数为 ______
(2)![]() 至10min时速率变化的原因可能是 ______ ;
至10min时速率变化的原因可能是 ______ ;
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )
2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率始终相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的转化率:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是( )

A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.绿原酸可发生加成、氧化和取代反应
D.W既属于羧酸类化合物又属于酚类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄![]() 酒,即是用研磨成粉末的雄黄泡制的白酒或黄酒,中华民族传统节日端午节的饮品。雌黄
酒,即是用研磨成粉末的雄黄泡制的白酒或黄酒,中华民族传统节日端午节的饮品。雌黄![]() 是工业制取高纯度砷的重要原料,下图是工业制纯砷流程:
是工业制取高纯度砷的重要原料,下图是工业制纯砷流程:
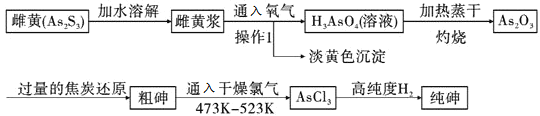
已知:砷在元素周期表中,位于硅元素相邻的右下角位置。
![]() 操作1的名称________。
操作1的名称________。
![]() 写出雌黄浆中通入氧气的化学方程式________。
写出雌黄浆中通入氧气的化学方程式________。
![]() 在粗砷的提纯过程中通常将温度控制在
在粗砷的提纯过程中通常将温度控制在![]() 以上,其目的是什么?________。
以上,其目的是什么?________。
![]() 在粗砷的提纯过程中,通入氯气这步操作为什么必须在干燥的环境中进行?________。
在粗砷的提纯过程中,通入氯气这步操作为什么必须在干燥的环境中进行?________。
![]() 写出
写出![]() 在灼烧条件下生成
在灼烧条件下生成![]() 的化学方程式:________。
的化学方程式:________。
![]() 砒霜的主要成分是
砒霜的主要成分是![]() ,古时候确定人是否砒霜中毒,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀硫酸,得到一种气体A,加热气体A,会得到单质砷。请写出A的化学式________。
,古时候确定人是否砒霜中毒,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀硫酸,得到一种气体A,加热气体A,会得到单质砷。请写出A的化学式________。
![]() 亚砷酸
亚砷酸![]() ,是三元弱酸,第一步和第二步产生
,是三元弱酸,第一步和第二步产生![]() 是通过和水中的氢氧根结合实现的,第三步则直接电离出
是通过和水中的氢氧根结合实现的,第三步则直接电离出![]() 。第一步电离方程式为:
。第一步电离方程式为:![]() ,第二步的电离方程式为________。
,第二步的电离方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H=+QkJmol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
Si(s)+4HCl(g);△H=+QkJmol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强则化学反应速率降低
B.若反应开始时 SiCl4 为 1mol,则达到平衡时,吸收热量为 QkJ
C.反应至 4min 时,若HCl的浓度为 0.12molL-1,则 H2 的反应速率为 0.03mol/(Lmin)
D.当反应吸收热量为 0.025QkJ 时,生成的 HCl 通入 100mL1molL-1 的 NaOH 恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com