
| A. | 醋酸钡与硫酸反应:Ba2++SO42-→BaSO4↓ | |
| B. | 金属铝溶于稀硫酸:Al+2H+→Al3++H2↓ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO- | |
| D. | 碳酸氢钠和盐酸反应:HCO3-+H+→CO2↑+H2O |
分析 A.二者反应生成硫酸钡和醋酸,漏掉醋酸根离子与氢离子的反应;
B.电荷不守恒;
C.次氯酸为弱酸,应保留化学式;
D.二者反应生成而二氧化碳和氯化钠和水;
解答 解:A.醋酸钡与硫酸反应,离子方程式:2CH3COO-+2H++Ba2++SO42-→BaSO4↓+2CH3COOH,故A错误;
B.金属铝溶于稀硫酸,离子方程式:2Al+6H+→2Al3++3H2↓,故B错误;
C.将氯气溶于水制备次氯酸,离子方程式:Cl2+H2O→H++Cl-+HClO,故C错误;
D.碳酸氢钠和盐酸反应,离子方程式:HCO3-+H+→CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查复分解反应的离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循电荷守恒规律.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:2017届云南省高三上第二次周考化学试卷(解析版) 题型:选择题
不能正确表示下列反应的离子方程式是
A.Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑
B.Na2O2溶于水产生O2:2Na2O2+2H2O═4Na++4OH﹣+O2↑
C.碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3﹣+OHˉ═CaCO3↓+H2O
D.饱和碳酸钠溶液中通入过量二氧化碳气体 CO32﹣+CO2+H2O═HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHSO4?Na ++HSO4- | ||
| C. | NaHCO3?Na++H++CO32- | D. | HCO3-?CO32-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
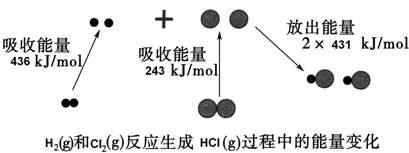
| A. | 1 mol H2(g)和1 mol Cl2(g)具有的总能量大于2 mol HCl(g)具有的总能量 | |
| B. | 该反应的△H>0 | |
| C. | 通常情况下,H2(g)和Cl2(g)混合容易直接生成HCl(g) | |
| D. | 生成的HCl溶于水会发生电离,即HCl=H++Cl-,由此判断,HCl中存在离子键 |
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第二次周考化学试卷(解析版) 题型:选择题
用NA代表阿伏伽德罗常数,下列说法正确的是
A.46克NO2和N2O4混合气体中所含原子数为3NA
B.标准状况下,11.2LCH2Cl2所含的分子数为0.5NA
C.0.5NA氖气分子中含有氖原子1NA
D.25℃时,pH=13的1L硫酸溶液中含有H+的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )| A. | 该物质可以视为醇类 | |
| B. | 不能使溴的四氯化碳溶液褪色,但可以使酸性的高锰酸钾溶液褪色 | |
| C. | 在浓硫酸作用下,分子内消去一个水分子,产物有两种同分异构体 | |
| D. | 该物质分子中的所有碳原子不可能共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.3mol | B. | 大于0.3mol | ||
| C. | 大于0.3mol,小于0.6mol | D. | 等于0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com