
【题目】Ⅰ.氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O.
(1)该反应中发生还原反应的物质是________。氧化产物是________。
(2)用双线桥标出方程式中的电子得失2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O________。
(3)当有0.2 mol电子发生转移时,生成的氯气的体积为________L (标准状况)。被氧化的HCl的物质的量为________mol.
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+) ③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
Ⅱ.检测人的血液中葡萄糖(简称血糖,相对分子质量为180)含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1 L=l0dL)。以“mmol/L”表示时,人的血糖正常值在3.6~6.0 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是________。
【答案】KClO3 Cl2 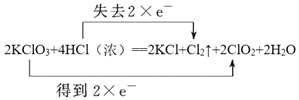 2.24 0.2 ② 64.8~108.0 mg/dL
2.24 0.2 ② 64.8~108.0 mg/dL
【解析】
Ⅰ.(1)依据氧化还原反应的规律作答;
(2)KClO3转化为ClO2转移电子数为2![]() e-,HCl中Cl元素化合价升高,失去电子数为2
e-,HCl中Cl元素化合价升高,失去电子数为2![]() e-,据此利用双线桥法分析;
e-,据此利用双线桥法分析;
(3)当有0.2mol电子发生转移时,生成的氯气是0.1mol;
(4)利用假设法,根据电子守恒分析作答;
Ⅱ. 1mmol=10-3mol,1g=103mg,1L=10dL;根据上述单位的转化关系将已知的正常血糖范围3.6~6.0 mmol/L转化为以“mg/dL”为单位的数据。
Ⅰ.(1)氯酸钾中氯元素化合价从+5价降低到+4价,得到1个电子,因此该反应中发生还原反应的物质是KClO3。氯化氢中氯元素化合价从-1价升高到0价,失去电子,则氧化产物是Cl2;
(2)根据以上分析可知用双线桥标出方程式中的电子得失为 ;
;
(3)当有0.2mol电子发生转移时,生成的氯气是0.1mol,在标准状况下的体积为2.24L;根据氯原子守恒可知被氧化的HCl的物质的量为0.2mol;
(4)假设均是1mol氧化剂参加反应,根据电子得失守恒可知1mol高锰酸钾得到氯气的物质的量是2.5mol,1mol二氧化锰得到氯气的物质的量是1mol,根据方程式Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O可知1mol次氯酸钙得到2mol氯气,所以生成氯气的物质的量最少的是二氧化锰,答案选②;
Ⅱ. 1mmol=10-3mol,1g=103mg,1L=10dL,1L中3.6mmol血糖的质量为:3.6×10-3mol×180×103mg/mol=648mg,用“mg/dL”表示血糖的浓度为:![]() =64.8 mg/dL;6.0 mmol血糖的质量为:6.0×10-3mol×180×103mg/mol=1080 mg,用“mg/dL”表示血糖的浓度为:
=64.8 mg/dL;6.0 mmol血糖的质量为:6.0×10-3mol×180×103mg/mol=1080 mg,用“mg/dL”表示血糖的浓度为:![]() =108.0 mg/dL,故以“mg/dL”表示血糖的正常值范围是:64.8~108.0 mg/dL之间,故答案为:64.8~108.0 mg/dL。
=108.0 mg/dL,故以“mg/dL”表示血糖的正常值范围是:64.8~108.0 mg/dL之间,故答案为:64.8~108.0 mg/dL。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】植物的绿色细胞在光照下吸收O2、释放CO2的现象,称为光呼吸。研究发现,光呼吸是光照条件下O2/CO2的值异常时发生的一种生理过程,光呼吸和光合作用暗反应的关系如图所示。请回答下列有关问题:
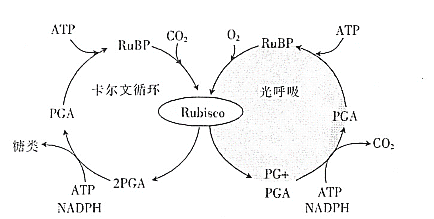
注:RuBP为1,5-二磷酸核酮糖,是卡尔文循环里起重要作用的一种五碳糖;PGA为三磷酸甘油酸,是一种三碳化合物;PG为二碳化合物;Rubisco为1,5-二磷酸核酮糖羧化酶/加氧酶。
(1)植物的卡尔文循环中,RuBP结合CO2的过程发生在_______________(填场所)中,图中卡尔文循环和光呼吸均利用的物质有_______________。结合上图,请从O2和CO2含量的角度分析,光照条件下光呼吸进行的条件是_______________。
(2)光呼吸的最终产物是_______________,这个过程是_______________(填“产生”或“消耗”)能量的过程。
(3)根据图中光呼吸与光合作用暗反应的关系推测,抑制光呼吸对农作物生产的意义是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法合理的是
①根据纯净物中是否含氧元素,来判断是否属于氧化物
②根据电泳现象可证明胶体带电荷
③直径介于lnm~l00nm之间的微粒称为胶体
④金属氧化物都是碱性氧化物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液
⑥同一钢笔使用不同牌号的墨水容易堵塞,是由于胶体的聚沉
A. 只有⑥ B. 只有②⑥ C. 只有③④⑤ D. 只有①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.当氢氧酸性燃料电池中转移2mol电子时被氧化的分子数为NA
C.0.5mol雄黄(As4S4,结构如图![]() ),含有NA个S—S键
),含有NA个S—S键
D.一定条件下向密闭容器中充入1molH2和2molH2(g)充分反应,生成HI分子数最多等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是
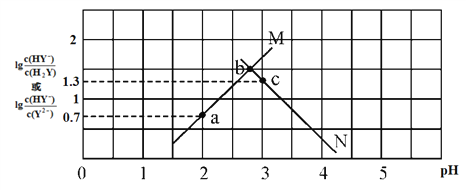
A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是
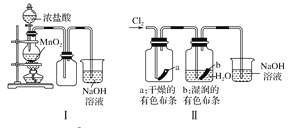
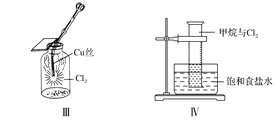
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B. Ⅱ图中:湿润的有色布条能褪色,烧杯NaOH溶液的作用是吸收尾气
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:量筒中发生了加成反应,量筒内液面上升,量筒壁上有无色液滴出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的结构简式如下:

(1)A分子中含有的官能团的名称是____________________________________。
(2)A、B能否与NaOH溶液反应:A________(填“能”或“不能”,下同),B________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是____________________。
(4)A、B各1 mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是________mol、________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:

下列说法不正确的是
A. CCl4起到萃取、富集I2的作用
B. a中下层变无色,说明I2 转化为I-
C. Ⅲ中发生反应的离子方程式为:Br2 + 2I-=== I2 + 2Br-
D. 依据a、b中现象,可以证明Cl2的氧化性比 Br2强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,将达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,将达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com