
| A、20% | B、40% |
| C、60% | D、80% |
| V |
| Vm |
| 11.2L |
| 22.4L/mol |
| 15.68L |
| 22.4L/mol |
| 0.7mol |
| 0.5mol |
|
| 0.2mol |
| 0.5mol |


科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
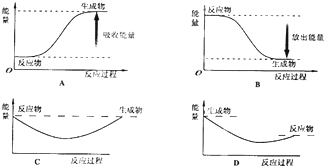
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
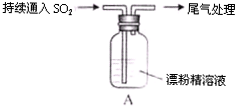 | i液面上方出现白雾; ii稍后,出现浑浊,溶液变为黄绿色; iii稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、部分为 Al(OH)3沉淀,部分以Al3+形式存在 |
| B、全部以[Al(OH)4]-(AlO2-)的形式存在 |
| C、全部为Al(OH)3沉淀 |
| D、部分为Al(OH)3,部分为[Al(OH)4]- (AlO2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com