
【题目】将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解。向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如图曲线所示。则盐酸的物质的量浓度为( )

A.1mol/LB.8mol/LC.10mol/LD.12mol/L
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是( )

A.过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程Ⅱ,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
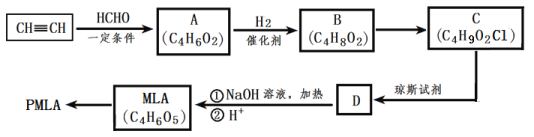
【题目】聚苹果酸(PMLA),是一种生物医学材料,可由苹果酸(MLA)经聚合反应生成。PMLA的一种合成路线如图所示。
已知:①R1-C![]() CH+
CH+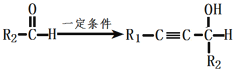
②R-CH2OH![]() R-COOH
R-COOH
(1)A中含有官能团名称为___、___。
(2)B到C的反应类型为___反应。
(3)B的核磁氢谱中有三组峰,其峰面积比为1:1:2,B的结构简式为___。
(4)D与NaOH溶液在加热条件下反应的化学方程式为___。
(5)上述转化关系中B→C和C→D这两步的顺序能否颠倒___(填“能”或“不能”),理由是___。
(6)写出与MLA具有相同官能团的所有同分异构体的结构简式___(不包含MLA)。
(7)聚酯PMLA有多种结构,写出由MLA制PMLA的化学方程式___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO3与SnCl2在浓盐酸中反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-=2As+3SnCl62-+6M。关于该反应的说法中错误的是
A.M为H2O
B.还原剂是Sn2+,还原产物是As
C.氧化性:H3AsO3>SnCl62-
D.每生成7.5 g As,转移的电子为0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量约为4000的聚乙二醇具有良好的水溶性,是一种缓泻剂。聚乙二醇可由环氧乙烷在酸性条件下聚合而成(![]() )。下列说法正确的是
)。下列说法正确的是
A.环氧乙烷在酸性条件下发生加聚反应制得聚乙二醇
B.聚乙二醇的结构简式为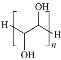
C.相对分子质量约为4000的聚乙二醇的聚合度n≈67
D.聚乙二醇能保持肠道水分的原因是其可和H2O分子间形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.78克镁铝的混合物投入到25mL30.625%稀硫酸(密度为1.28g/cm3)中,充分反应,在标准状态下得到气体体积0.896L(气体基本上全部收集),在反应后的溶液中加入4mol/L NaOH溶液,使镁离子完全沉淀,铝离子沉淀完全消失.通过计算回答下列问题:
(1)稀硫酸的物质的量浓度为______mol/L
(2)混合物中铝的质量为______。
(3)反应后溶液中加入4mol/L NaOH溶液的体积至少为多少毫升才能使氢氧化铝和氢氧化镁沉淀分开?______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
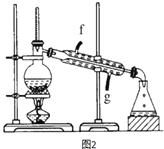
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制环己烯。
已知:![]()
密度( | 熔点℃ | 沸点℃ | 溶解性 | |
环己醇 | 0.096 | 25 | 161 | 能溶于水 |
环己烯 | 0.081 | -103 | 83 | 难溶于水 |
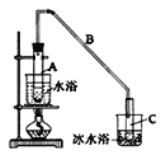
制备粗品:
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
(1)A中瓷片的作用是______,导管B除了导气外还具有的作用是______;
(2)试管C置于冰水浴中的目的是__________________________。
制备精品:
(3)环己烯粗品中含有环己醇和少量酸性杂质等。加入少量食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用_________(填入编号)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
(4)再将环己烯按图2装置蒸馏,冷却水从_______(填f或g)口进入,蒸馏时要加入生石灰,目的是______________。收集产品时,温度应控制在_____左右。
(5)以下区分环己烯精品与粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
若用上述装置制备乙酸乙酯,回答下列问题。
(6)用分液漏斗提纯试管C中的乙酸乙酯,在操作时要注意振荡洗涤后,静置分液前必须放气,具体操作方法是__________(填编号)
a.将仪器正放在架子或铁圈上打开上部塞子
b.将仪器正放在架子或铁圈上打开活塞
c.用手心抵住仪器上部塞子倒置后打开活塞
d.将该仪器平放在实验台上打开活塞
(7)所制得的酯应从该分液漏斗的__________(填编号)
a.下部流出 b.上口倒出 c.都可以
(8)在提纯乙酸乙酯时,为什么要使用饱和碳酸钠溶液,而不用NaOH溶液洗涤?
______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com