
【题目】下列物质属于含有共价键的离子化合物的是
A. C60 B. C6H6 C. KF D. NaOH
科目:高中化学 来源: 题型:
【题目】下列实验过程中的现象及结论均正确的是

A. 锥形瓶中有气体产生,烧杯中液体变浑浊,证明非金属性:Cl>C>Si
B. 形成美丽的红色喷泉,证明HC1极易溶于水
C. 配制一定物质的量浓度的NaOH溶液时,定容时如图观察使配制的NaOH 溶液浓度偏低
D. 只产生红褐色沉定,证明Ksp[Al(OH3)]>Ksp[Fe(OH)3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列说法正确的是( )
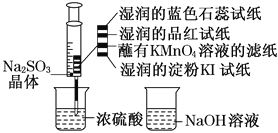
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、蘸有KMnO4溶液的滤纸均褪色能证明SO2的漂白性
C. 湿润的淀粉KI试纸未变蓝说明SO2的氧化性强于I2
D. NaOH溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据S2O82-+2e-→2SO42-,Mn2++4H2O→MnO4-+8H++5e-,推测氧化1.5molMn2+需要Na2S2O8的物质的量为
A.1.5molB.3.75molC.3.25molD.3.125mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是有化学键断裂的变化一定是化学变化
B. 吸热反应一定需要加热才能发生
C. 含共价键的化合物一定是共价化合物
D. 活泼的金属与活泼的非金属元素也可以形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MaSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:_________________________________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() Mn0(s)+CO2(g)△H1 K1
Mn0(s)+CO2(g)△H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2
③2MnCO3(n)+O2(g)![]() 2MnO2(s)+2CO2(g)△H3 K3
2MnO2(s)+2CO2(g)△H3 K3
△H3=________用△H1,△H2表示);K3=________用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H3________0(填“>"“<"或“=")。
(4)在密闭容器中投入足量的MnCO3,一定条件下发生反应MnCO3(s)![]() MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
①温度、压强对MnCO3分解率的影响如图所示:
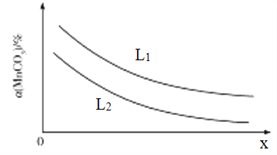
比较:L1__________L2(填“>"“<”或“=")。
②保持温度不变,将容器休积扩大至原来的2倍,则ρ(CO2)的变化范围是____________。
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量一定不变的是____(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定温度下,在容积为2L的恒容密闭容器中加入足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。

①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧1g乙炔生成二氧化碳和液态水,放出热量50kJ,则这一反应的热化学反应方程式为( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+50 kJ?mol﹣1
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(g)△H=﹣1300 kJ?mol﹣1
O2(g)═2CO2(g)+H2O(g)△H=﹣1300 kJ?mol﹣1
C.2C2H2+5O2═4CO2+2H2O△H=﹣2 600 kJ
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2600 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强碱性溶液中可以大量共存的是( )
A. K+、Na+、H+、Cl- B. Na+、Ba2+、NO3-、Cl-
C. K+、NH4+、S2-、CO32- D. Ca2+、Na+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com