
【题目】下列叙述表示可逆反应N2 + 3H2 ![]() 2NH3一定处于平衡状态的是
2NH3一定处于平衡状态的是
A. N2、H2、NH3的百分含量相等
B. 单位时间,消耗a mol N2的同时消耗3a mol H2
C. 单位时间,消耗a molN2的同时生成3a mol H2
D. 反应若在定容的密器中进行,温度一定时,压强不随时间改变
【答案】CD
【解析】
A.N2、H2、NH3的百分含量等时,不一定是平衡状态;B.单位时间,消耗a mol N2的同时消耗3a mol H2都体现的正反应方向,未反映正与逆的关系;C.单位时间,消耗a molN2的同时生成3a mol H2,正逆反应速率相等;D.反应若在定容的密器中进行,温度一定时,压强不随时间改变,说明气体的总物质的量不变,达平衡状态;
A.化学平衡时N2、H2、NH3的百分含量不变,百分含量相等时,不一定是平衡状态,故A项错误;B.单位时间,消耗a mol N2的同时消耗3a mol H2都体现的正反应方向,未反映正与逆的关系,故B项错误;C.单位时间,消耗a molN2的同时生成3a mol H2,正逆反应速率相等,故C项正确;D.反应若在定容的密器中进行,温度一定时,压强不随时间改变,说明气体的总物质的量不变,达平衡状态,故D项正确;综上,本题选CD。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应中生成物总能量高于反应物总能量的是
A. 铁与盐酸反应 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. Ba(OH)2·8H2O 与NH4Cl 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2===2Fe3++2Br-,2Br-+Cl2===Br2+2Cl- , 2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是
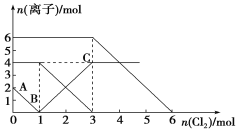
A. 还原性:I->Fe2+>Br-
B. 当通入2 molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C. 原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
D. 原混合溶液中FeBr2的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4B.铜、二氧化硫
C.硫酸、乙醇D.熔融的KNO3、硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1个丙烯分子中有6个![]() 键,1个
键,1个![]() 键
键
B. 在晶体中,1个Si原子和2个O原子形成2个共价键![]()
C. 12g石墨中含有的C-C键数目为2NA
D. 124gP4分子中含有P-P键的数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知3N2H4(l)![]() 4NH3(g)+N2(g) △H = —336.6kJ/mol,
4NH3(g)+N2(g) △H = —336.6kJ/mol,
N2(g)+3H2(g)![]() 2NH3(g) △H = —92.4kJ/mol,
2NH3(g) △H = —92.4kJ/mol,
则N2H4(g)![]() N2(g)+2H2(g) △H = ________________。
N2(g)+2H2(g) △H = ________________。
(2)写出下列物质的电离方程式:
①NaHSO4___________________________________,
②K2SO4_____________,
③NH4NO3___________________________。
(3)写出下列物质的电子式:
Na2S:_________;CO2:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属锂、熔融硫和多硫化锂[Li2Sx(2≤x≤8)]分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列说法错误的是
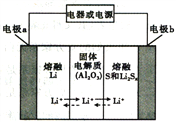
A. 该电池比钠一液态多硫电池的比能量高
B. 放电时,内电路中Li+的移动方向为从a到b
C. Al2O3的作用是导电、隔离电极反应物
D. 充电时,外电路中通过0.2mol电子,阳极区单质硫的质量增加3.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G七种元素的原子序数依次递增,前四种元素为短周期元素![]() 位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性;C与G同主族。
位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性;C与G同主族。
(1)![]() 基态原子的价电子轨道排图为______,B2A2的电子式为_______,CD3-的空间构型为______ .
基态原子的价电子轨道排图为______,B2A2的电子式为_______,CD3-的空间构型为______ .
(2)F(BD)n的中心原子价电子数与配体提供电子总数之和为18(1个BD分子可提供的电子数为2),则![]() ______
______ ![]() 根据等电子原理,B、D分子内
根据等电子原理,B、D分子内![]() 键与
键与![]() 键的个数之比为______ .
键的个数之比为______ .
(3)FXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为![]() ,若晶体中的F分别为F2+、F3+,此晶体中F2+与F3+的最简整数比为______ .
,若晶体中的F分别为F2+、F3+,此晶体中F2+与F3+的最简整数比为______ .
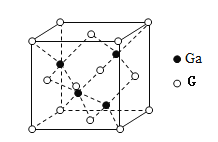
(4)G元素与Ga可形成原子晶体GaG,其晶胞结构如图所示,密度为![]() ,Ga和G的摩尔质量分别为M1g·mol-1和M2g·mol-1原子半径分别为r1pm和r2pm,阿伏伽德罗常数值为
,Ga和G的摩尔质量分别为M1g·mol-1和M2g·mol-1原子半径分别为r1pm和r2pm,阿伏伽德罗常数值为![]() ,则该晶胞中原子的体积占晶胞体积的百分率为______.(写出用M1、和M2、r1、r2、ρ表示的计算式)
,则该晶胞中原子的体积占晶胞体积的百分率为______.(写出用M1、和M2、r1、r2、ρ表示的计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
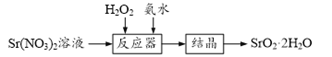
反应原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3,该反应放热。
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是______。
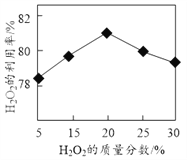
(2)SrO2·2H2O与CO2会反应变质,反应的化学方程式为______。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当c(Sr2+)=0.0010 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=______。[已知25℃时:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9]
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol·L-1 Na2S2O3标准液滴定到蓝色恰好消失时,共消耗标准液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程________。(已知:S2O32-![]() S4O62-)
S4O62-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com