
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( ) 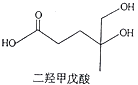
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】综合题。
(1)在同温、同压下,实验测得CO,N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 . 若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 .
(2)相同条件下,某Cl2与O2混合气体100mL恰好与150mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 , 混合气体的平均相对分子质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,易溶于水,其水溶液与酸性KMnO4溶液反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)步骤①需要使用烧杯、量筒、玻璃棒、胶头滴管,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(2)本实验滴定达到终点的标志是__________________________;
(3)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(4)若滴定终点时俯视滴定管刻度,则x值会______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为探究ClO﹣、I2、SO ![]() 在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下: 实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下: 实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
实验②:向实验①的溶液中加入4L 0.5mol/L的Na2SO3溶液,发生反应如下
SO ![]() +I2+H2O→SO
+I2+H2O→SO ![]() +I﹣+H+(未配平),恰好完全反应.
+I﹣+H+(未配平),恰好完全反应.
(1)以上实验说明,在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是 .
(2)实验②中化学反应转移电子的物质的量是 .
(3)写出实验①中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是( )
A.HCO3﹣+H2OH3O++CO32﹣
B.NH4++H2ONH3H2O+OH﹣
C.PO43﹣+H2OHPO42﹣+OH﹣
D.H2O+H2OH3O++OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙烯分子中有5个σ键、一个π键,它们分别是( )。
A.未杂化的sp2轨道形成σ键、杂化的2p轨道形成π键
B.杂化的sp2轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间有未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间有未参加杂化的2p轨道形成的π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共10分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) ![]() H= 242.0 kJ/mol
H= 242.0 kJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= 110.0 kJ/mol
H= 110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol。则反应CH4(g)+ H2O(g) ![]() CO(g)+3H2(g)△H= kJ/mol。
CO(g)+3H2(g)△H= kJ/mol。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是 。
A.2mo1 CO和4mol H2 B.2mo1 CO、4mol H2和1mol CH3OH(g)
C.4mo1 CO和4mol H2 D.4mo1 CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%。若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜有很多奇特的性质,比如超塑延展性,在室温下可拉长50多倍而不出现裂纹,铜纳米晶体的这种机械特性为制造常温下的弹性物质开辟了光明前景。此外,纳米铜还用作热氨发生器、凝胶推进剂、燃烧活性剂、催化剂、水清洁吸附剂、烧结活性剂等。纳米铜比普通铜更容易与氧气发生反应,常温下在空气中可以自燃。以下是纳米铜的一种制备工艺,用于制备50~100nm的铜粉。

已知:油酸(C17H33COOH)难溶于水,可溶于乙醇。
步骤①中发生的反应为:2C17H33COOH +Cu2+![]() Cu(C17H33COO)2 +2H+
Cu(C17H33COO)2 +2H+
步骤②中发生的反应为:2Cu(C17H33COO)2 + C6H12O6+5OH- =Cu2O+C5H11COO-+4C17H33COO-
回答下列问题:
(1)将纳米铜粉加人燕馏水中,搅拌均匀后,得到的分散系类型是_________
(2)步骤①中调节pH5.5~6.0时,萃取率最高,pH不能过大也不能过小,若过小则______,若过大则__。
(3)NaH2PO2中P的化合价是_______,在步骤③中被氧化得到的产物是NaH2PO3,该反应的化学方程式是_____。已知NaH2PO2为正盐且溶液呈碱性.NaH2PO2溶液呈碱性原因用离子方程式可表示为_。
(4)用乙醇清洗产物的目的是__________。
(5)真空干燥产品的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com