
����Ŀ����Ȳ���ڴ��������¿ɷ���ż����Ӧ����ΪGlaser��Ӧ��2R��C��C��H![]() R��C��C��C��C��R+H2���÷�Ӧ���о����ͷ�����ϡ������ӻ�ѧ�ȷ��������Ҫ��ֵ������������Glaser��Ӧ�Ʊ�������E��һ�ֺϳ�·�ߣ�
R��C��C��C��C��R+H2���÷�Ӧ���о����ͷ�����ϡ������ӻ�ѧ�ȷ��������Ҫ��ֵ������������Glaser��Ӧ�Ʊ�������E��һ�ֺϳ�·�ߣ�
�ش��������⣺
��1��B�Ľṹ��ʽΪ_____����Ӧ��������Լ���������______����Ӧ�۵ķ�Ӧ����Ϊ______��Ӧ��
��2��1molE�����������������_____mol��
��3�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3��1��д������һ�ֵĽṹ��ʽ______��
��4��д����2�����Ҵ�![]() ��Ϊԭ�ϣ��������Լ���ѡ���Ʊ�������D�ĺϳ�·��______��
��Ϊԭ�ϣ��������Լ���ѡ���Ʊ�������D�ĺϳ�·��______��
���ϳ�·�߳��õı��﷽ʽΪ��A![]() B
B![]() ����Ŀ����
����Ŀ����
���𰸡�![]() Cl2������ ��ȥ���������� 10
Cl2������ ��ȥ���������� 10 ![]() ��
�� ��
�� ��
��![]() ��
��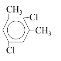
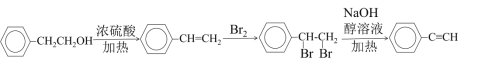
��������
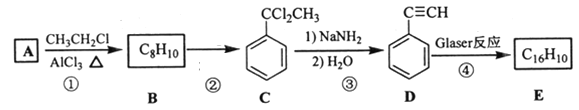
��B�ķ���ʽ��C�Ľṹ��ʽ��֪B�Ľṹ��ʽΪ![]() ����A�������鷢��ȡ����Ӧ����B����AΪ
����A�������鷢��ȡ����Ӧ����B����AΪ![]() ���Ա�C��D�Ľṹ��ʽ��֪C��ȥ2����HCl��ͬʱ�γ�DΪ����Ȳ���÷�Ӧ������ȥ��Ӧ��D������Ϣ�е�ż����Ӧ����EΪ
���Ա�C��D�Ľṹ��ʽ��֪C��ȥ2����HCl��ͬʱ�γ�DΪ����Ȳ���÷�Ӧ������ȥ��Ӧ��D������Ϣ�е�ż����Ӧ����EΪ![]() ��2�����Ҵ���Ũ���ᡢ���������·�����ȥ��Ӧ���ɱ���ϩ��Ȼ����ϩ���巢���ӳɷ�Ӧ����
��2�����Ҵ���Ũ���ᡢ���������·�����ȥ��Ӧ���ɱ���ϩ��Ȼ����ϩ���巢���ӳɷ�Ӧ����![]() �������������ƴ���Һ�����������·�����ȥ��Ӧ���ɱ���Ȳ��
�������������ƴ���Һ�����������·�����ȥ��Ӧ���ɱ���Ȳ��
��1���ɷ�����֪B�Ľṹ��ʽΪ![]() ����Ӧ�ڷ���ȡ����Ӧ������֧���ϵ�̼ԭ�ӵ���ԭ�ӱ���ԭ��ȡ����������Լ���������Cl2�����գ���Ӧ�۵ķ�Ӧ����Ϊ��ȥ��Ӧ��
����Ӧ�ڷ���ȡ����Ӧ������֧���ϵ�̼ԭ�ӵ���ԭ�ӱ���ԭ��ȡ����������Լ���������Cl2�����գ���Ӧ�۵ķ�Ӧ����Ϊ��ȥ��Ӧ��
��2���ɷ���֪EΪ![]() ��1molE�����������������10mol��
��1molE�����������������10mol��
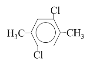
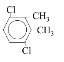
��3�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3��1�����ܵĽṹ��ʽΪ��![]() ��
��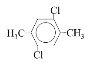 ��
��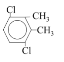 ��
��![]() ��
��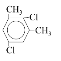 ��
��
��4��2�����Ҵ���Ũ���ᡢ���������·�����ȥ��Ӧ���ɱ���ϩ��Ȼ����ϩ���巢���ӳɷ�Ӧ����![]() �������������ƴ���Һ�����������·�����ȥ��Ӧ���ɱ���Ȳ���ϳ�·��Ϊ
�������������ƴ���Һ�����������·�����ȥ��Ӧ���ɱ���Ȳ���ϳ�·��Ϊ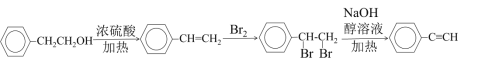 ��
��


 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��ݷ�Ӧԭ����Ƶ�Ӧ�ã�����ȷ����
A. CO32����H2O![]() HCO3����OH�����ȵĴ�����Һ��ϴ����
HCO3����OH�����ȵĴ�����Һ��ϴ����
B. Al3����3H2O![]() Al(OH)3��3H����������ˮ
Al(OH)3��3H����������ˮ
C. TiCl4��(x��2)H2O(����) ![]() TiO2��xH2O����4HCl����TiCl4�Ʊ�TiO2
TiO2��xH2O����4HCl����TiCl4�Ʊ�TiO2
D. SnCl2��H2O![]() Sn(OH)Cl����HCl�������Ȼ�������Һʱ������������
Sn(OH)Cl����HCl�������Ȼ�������Һʱ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������Ǵ�������(��Cr2O72-��CrO42-)��ҵ��ˮ�ij��÷������������£�

��֪��ת�������еķ�ӦΪ2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)��������Ksp[Cr(OH)3]=1��10-32������˵��������ǣ� ��
Cr2O72-(aq)+H2O(l)��������Ksp[Cr(OH)3]=1��10-32������˵��������ǣ� ��
A.��Ӧ��v��(CrO42-)=2v��(Cr2O72-)ʱ����Ӧ����ƽ��״̬
B.��Ӧ��ת��0.6mole-������0.2mol Cr2O72-����ԭ
C.��ȥ��ˮ�к������ӵĹ��̰���������ԭ��Ӧ���ֽⷴӦ
D.�����£�Ҫʹ�������ˮ�е�c(Cr3+)����1��10-5mol��L-1����Ӧ��Ӧ����ҺpH=5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС����������ͼ��ʾ��ʵ��װ�D̽������Һ��ķ�Ӧ����֪��MnO2+2NaBr+2H2SO4![]() Br2��+MnSO4+Na2SO4+2H2O������˵������ȷ���ǣ���
Br2��+MnSO4+Na2SO4+2H2O������˵������ȷ���ǣ���
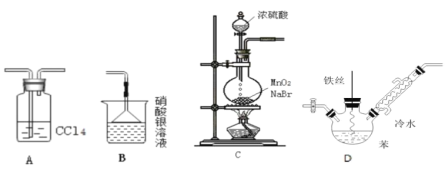
A. װ��A�������dz�ȥHBr�е�������
B. װ��B�������Ǽ���Br
C. ������װ��C��ȡ����
D. ��װ��D��Ӧһ��ʱ�������˿��Ӧ����ֹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ƽ��仯������й�˵������ȷ����(����)
A.����CuSO4��Һ��Ӧ�����ӷ���ʽΪ2Na+Cu2+�TCu+2Na+
B.7.8 g Na2O2��������Ϊ0.4NA
C.�������Ƽ���еļ�ָNaHCO3
D.��Na2CO3������Һ��ͨ��������CO2����NaHCO3�ᾧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuS��Cu2S���ڴ������Է�ˮ�е�Cr2O72-����Ӧ���£�
��Ӧ��CuS��Cr2O72-��H����Cu2����SO42-��Cr3����H2O(δ��ƽ)��
��Ӧ��Cu2S��Cr2O72-��H����Cu2����SO42-��Cr3����H2O(δ��ƽ)
�����й�˵����ȷ����
A.��Ӧ��͢��и���2��Ԫ�صĻ��ϼ۷����仯
B.��Ӧ���л�ԭ���������������ʵ���֮��Ϊ3��5
C.����1mol Cr2O72-ʱ��Ӧ��������H�������ʵ������
D.������ͬʱ��Cu2S��ȥ�������Cr2O72-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û���̿��ԭ�����Դ����������ij�о�С����2L�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)��2NO(g) ![]() N2(g)��CO2(g) ��H��0����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ��(mol/L)�����ʾ��������˵������ȷ����
N2(g)��CO2(g) ��H��0����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ��(mol/L)�����ʾ��������˵������ȷ����
ʱ��/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
A. 10~20 min�ڣ�NO��ƽ����Ӧ����Ϊ0.018mol/��Lmin��
B. T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=0.25
C. ������ǰ30min�ķ�Ӧ������ͬ�����������м���2molN2��2molNO����ƽ�������ƶ�
D. 30min��ֻ�ı���һ���������������������жϣ�����������Ϊ��С�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ���ܺ���Cl����![]() ��
��![]() ��
��![]() ��Mg2+��Fe3+��Na+��K+���ɴ˿�֪ԭ��Һ��(����)
��Mg2+��Fe3+��Na+��K+���ɴ˿�֪ԭ��Һ��(����)
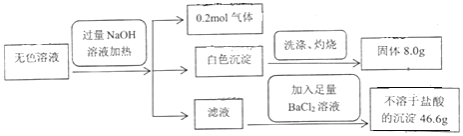
A.���ٴ���5������
B.![]() ��
��![]() ��Mg2+һ�����ڣ�Cl�����ܲ�����
��Mg2+һ�����ڣ�Cl�����ܲ�����
C.Fe3+��Na+��K+һ��������
D.Cl��һ�����ڣ�Na+��K+���ܴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ����Ҫ�Ļ����л�����ԭ�ϡ���ҵ�����ұ�����������ȡ����ϩ��
![]() (g)
(g)![]() (g)+H2(g) H=117.6kJ/mol
(g)+H2(g) H=117.6kJ/mol
��֪��������Ӧ�����ʷ���Ϊv��=k��P�ұ���v��=k��P����ϩP����������k����k���ֱ�Ϊ�����淴Ӧ���ʳ�����PΪ����ַ�ѹ��
(1)ͬʱ�����ұ��ķ�Ӧ���ʺ�ƽ��ת��������ȡ�Ĵ�ʩ��_______________��
(2)��CO2�����£��ұ��ɴ������Ʊ���ϩ�������ͬʱ������ͼ����;����
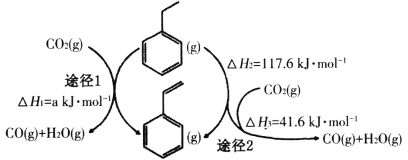
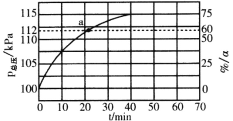
a=______�����ˮ����������ȣ��ù����л��ܹ�������Ӧ��CO2+H2=CO+H2O��CO2+C=2CO���¹��յ��ص���__________(�����)��
a.CO2��H2��Ӧ��ʹ�ұ����ⷴӦ�Ļ�ѧƽ������
b.���ø���ˮ�������ɽ�����������
c.�����ڼ������������п��ܲ����Ļ�̿
d.CO2�ڷ�Ӧ��ϵ��������
(3)��ʵ�������У�����Ӧ����ͬʱͨ���ұ���ˮ����������ˮ����ϡ�ͼ�������ұ�ת���ʵ�ԭ����_______________�����������ѹ(P��)���ұ�ת��������ʱ��仯�����ͼ��ʾ��ƽ��ʱ��P(H2O)=_______kPa��ƽ�ⳣ��Kp=____kPa(��ƽ���ѹ����ƽ��Ũ�ȼ���)��a����![]() =_________��
=_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com