
| A、无沉淀生成 |
| B、得到的沉淀是BaSO4和BaSO3组成的混合物 |
| C、得到的沉淀是纯净物 |
| D、肯定没有BaSO3生成 |


科目:高中化学 来源: 题型:
| A、生铁中含有碳,抗腐蚀能力比纯铁强 |
| B、铁与盐溶液所发生的反应都是置换反应 |
| C、铁与稀硫酸反应,铁与浓硫酸不能反应 |
| D、工业上可以用铝热反应的方法制取少量的铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焦炭是铁矿石炼铁时的还原剂 |
| B、焦炭先与空气中的氧气反应,为炼铁提供能量 |
| C、石灰石是助矿石中杂质形成炉渣 |
| D、固体原料需粉碎,增大与气体的接触面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应为不属于氧化还原反应 |
| B、Al2O3是氧化剂 |
| C、每生成2mol AlN转移6 mol电子 |
| D、C发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3═2Na++CO32- |
| B、NaHCO3═Na++HCO3- |
| C、H2SO4═2H++SO42- |
| D、KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2 升氯气含有的分子数为0.5NA |
| B、在常温常压下,1摩尔气体含有的原子数为NA |
| C、32 g氧气所含原子数目为2NA |
| D、在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
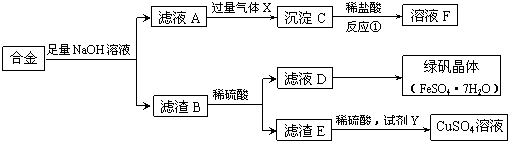
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com