
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温作用、环形玻璃搅拌棒进行搅拌使其充分反应、读取反应中温度计的最高温度、取2-3 次的实验平均值,以达到良好的实验效果 |
| B、纸上层析属于色谱分析法,其原理仅和“毛细现象”相关 |
| C、向1mL0.5mol?L-1AlCl3溶液中滴加2mL饱和NaF溶液,再滴加1mL 3.0mol?L-1 NH3?H2O溶液,无沉淀生成,说明Al3+更易与F-结合成AlF63-- |
| D、为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度 (mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.2 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
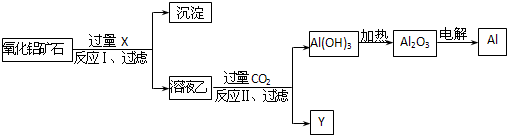
| A、试剂X可以为氨水,沉淀中含有铁的化合物 |
| B、CO2可以用H2SO4溶液或稀盐酸代替 |
| C、反应II中的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、工业上还可采用Fe还原Al2O3的方法制Al,成本更低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
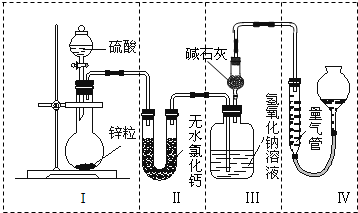 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于可逆反应来说,反应物只有按等物质的量投料,其转化率才能相等 |
| B、AgCl悬浊液中存在平衡:AgCl(s)?Ag+ (aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C、常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ |
| D、等浓度的下列稀溶液:①硫酸氢钠、②乙酸钠、③醋酸、④碳酸氢钠、⑤硝酸钠、⑥苯酚钠,它们的PH由小到大排列的为:①③⑤②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com