
����Ŀ����һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ����ͼ���ش��������⣺
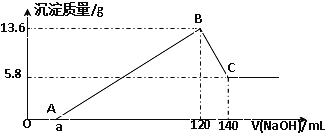
��1��д��OA�κ�BC�η�Ӧ�����ӷ���ʽ��
OA��________________________________ �� BC��_____________________________��
��2��ԭMg-Al�Ͻ��������_____________��
��3��ԭHCl��Һ�����ʵ���Ũ����________________��
��4������NaOH��Һ�����ʵ���Ũ����____________��
��5��a��ֵ��____________��
���𰸡� H++OH-=H2O Al(OH)3+OH-=AlO2-+2H2O 5.1�� 6mol/L 5mol/L 20
����������1����ͼ��֪��OA��û�г������ɣ�˵��ԭ��Һ�������ܽ�Mg��Al��������ʣ�࣬��ʱ�����ķ�ӦΪ��HCl+NaOH=NaCl+H2O����Ӧ�����ӷ���ʽΪ��H++OH-=H2O��BC���������������������Ʒ�Ӧ����ƫ��������ˮ����Ӧ�����ӷ���ʽΪ��Al(OH)3+OH-=AlO2-+2H2O����2��������þ�������������ƣ���ͼ��֪��������þ������Ϊ5.8g�����ʵ�����5.8g��58g/mol��0.1mol������þԭ���غ��֪����þ��������0.1mol��24g/mol��2.4g������������������Ϊ13.6g-5.8g=7.8g�������ʵ���Ϊ7.8g��78g/mol=0.1mol��������ԭ���غ��֪��������������0.1mol��27g/mol��2.7g������ԭMg-Al�Ͻ��������2.4g+2.7g��5.1g����3����Al(OH)3+OH-=AlO2-+2H2O��֪BC������������ȫ�ܽ�������������Ϊ0.1mol������������Һ���Ϊ140mL��120mL��20mL������c��NaOH��=0.1mol��0.02L=5mol/L��B��ʱ���������ʱ��Һ����ΪNaCl��������Ԫ���غ㣬n��NaCl��=n��NaOH��=0.12L��5mol/L=0.6mol��������Ԫ���غ�n��HCl��=0.6mol������������ʵ���Ũ��Ϊ0.6mol��0.1L=6mol/L����4���������Ϸ�����֪����NaOH��Һ�����ʵ���Ũ����5mol/L����5������0.1mol������þ��0.1mol�������������������Ʒֱ���0.2mol��0.3mol��������0.5mol����AB����������������Һ�������0.5mol��5mol/L��0.1L��100mL������a��120��100��20��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���ڻ�ԭ��Ӧ���ǣ� ��
A.Na �� Na2O2B.CO32- �� CO2C.H2O �� H2D.Cl- ��Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ֱ����ͭ˿�����������˵��л����Һ�������У���ͼ��ʾ�����������������( )
A.a����������������ɫ����
B.b�������������ֺ�ɫ
C.b�з���������ʴ
D.a��ͭ˿���������ݲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����25��ʱ��Kw=1.0��10��14 �� 100����Kw=1.0��10��12 �� ����˵��������ǣ� ��
A.100����ˮ�ĵ���̶Ƚϴ�
B.ǰ�ߵ�C��H+���Ϻ���С
C.ˮ�ĵ��������һ�����ȹ���
D.�¶�Խ�ߣ�KwԽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.����ռ�һ���Ǽ�B.SiO2��SO2��������������
C.���ܵ����H���Ļ�����һ������D.��������һ�����н�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ���������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ����֪RԪ�ص���������ϼ���������ϼ۵Ĵ�����Ϊ0��
����������⣺
��1��ZԪ�������ڱ��е�λ���� �� ͬ����ԭ�Ӱ뾶����Ԫ��������Ԫ�ط��ţ���
��2��X�ļ��⻯����M�ĵ��ʣ���һ�������¿��Է����û���Ӧ����ѧ����ʽΪ �� ��ԭ�����к��еĻ�ѧ����������
��3���ҹ����䡰���ۡ�ϵ�зɴ��ij������������X��Y��Һ̬�⻯����ȼ�ϡ���֪X��Y�������⻯���������ȣ����ҷ�Ӧʱ����������������Ⱦ�����ʡ�
��д�������⻯�ﷴӦ�Ļ�ѧ����ʽ �� ��Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ��
��X��Һ̬�⻯��ĵ���ʽ��
��4������˵����֤��R��Y�ǽ�����ǿ������____________��
A.R��Y�ĵ�����һ��������������RY2
B.Y���ʳ����������壬R�����ǹ���
C.Y���⻯���ȶ��Դ���R���⻯��
D.��Ȼ���д���Y���ʲ�����R����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ����Na+��Al3+��Cl����SO42�� �������ӣ���֪ǰ�������ӵĸ�����Ϊ3��2��1������Һ��Al3+�� SO42�������Ӹ�����Ϊ�� ��
A.1��2
B.1��4
C.3��4
D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����SO2��SO3��Ƚϣ�����˵���������( )
A. ���Ӹ���֮��Ϊ1��1 B. ������ԭ������֮��Ϊ3��4
C. ������Ϊ1��1 D. ������ԭ�Ӹ�����Ϊ2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ���װ����ͼ��ʾ��������װ���ñ����Ȼ�����Һ���ݹ�����֬������������ȷ���ǣ� �� 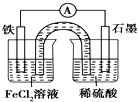
A.ԭ��ع���һ��ʱ���FeCl2��Һ��c��Cl��������
B.�˵�ع���ԭ�����̫���ܵ�ع���ԭ����ͬ
C.FeΪ������ʯī�Ϸ����ķ�ӦΪ2H++2e���TH2��
D.��װ���е�������ȫ���ý������ߴ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com