
【题目】某气态烃1 mol能与2 mol HBr完全加成,加成后产物分子上的氢原子又可被4 mol Cl2完全取代,则此气态烃可能是( )
A. CH≡CH B. CH≡C-CH3
C. CH2=CH-CH=CH2 D. CH2=C(CH3)2
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层的p能级中有3个未成对电子。
(1)C元素原子基态时的价电子排布式为________,若A元素为非金属元素,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(2)当n=2时,B的最简单气态氢化物的分子构型为________,中心原子的杂化方式为________,BC2属于________分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于________晶体。
(3)若A元素的原子最外层电子排布式为2s1,B元素的原子价电子排布式为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为____________________(填元素符号)。
(4)右图为C元素与钛、钙元素形成的某晶体结构中的最小重复单元,该晶体中每个钛原子周围与它最近且距离相等的钙离子有________个,该晶体的化学式为________________________。
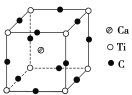
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在酸性溶液中能大量共存的是( )
A.Fe3+、NH4+、SCN﹣、Cl﹣
B.Na+、Mg2+、NO3﹣、SO42﹣
C.Al3+、Fe2+、NO3﹣、Cl﹣
D.K+、Na+、Cl﹣、SiO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1,下列说法不正确的是
A.CO(g)+![]() O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素。已知:①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4。请回答下列问题:
(1)F的稳定价态离子的电子排布式是________________,A、B、D、E四种元素的第一电离能由大到小的顺序为________________(用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是________,分子的立体构型为________________,该氢化物易溶于D的简单氢化物的主要原因是______________。
(3)D原子分别与A、B原子形成的单键中,键的极性较强的是________(用具体的化学键表示)。
(4)如图所示的晶胞是由A、D两元素组成的,下列有关该晶体的说法中正确的是________。
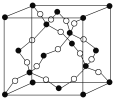
a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
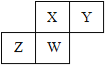
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态氮原子中电子在2p轨道上的排布遵循的原则是______________。前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为____________。
(2)C、N、O三种元素第一电离能从大到小的顺序是_______________。
(3)N2F2分子中氮原子的杂化方式是____________,
1 mol N2F2含有___________molσ键。
(4)NF3的键角____________NH3的键角(填“<”“>”或“=”),原因是____________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有________mol配位键。
(6)安全气囊的设计原理为6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①等电子体的原理是原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质。写出两种与![]() 互为等电子体的分子或离子____________;
互为等电子体的分子或离子____________;
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧离子的配位数为____________,Na2O晶体的密度为________g·cm-3(只要求列算式,不必计算出结果)。
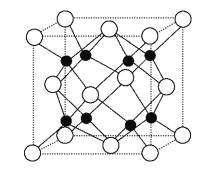
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证某有机物属于烃,应完成的实验内容是( )
A.只测定它的C,H比
B.只要证明它完全燃烧后产物只有H2O和CO2
C.只测定其燃烧产物H2O和CO2的物质的量之比
D.测定该试样的质量及完全燃烧后生成CO2和H2O的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com